
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология и педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по информатике программированию
Краткое содержание произведений
Реферат: Растворимость солей, кислот и оснований в воде (таблица)
Реферат: Растворимость солей, кислот и оснований в воде (таблица)
Растворимость солей, кислот и оснований в воде
Ионы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р | Р | - | Р | М | Н | Н | Н | - | Н | Н | Н | Н | Н | |
|
|
Р |
Р |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
|
|
Р | Р | Р | Н | Р |
Р |
Р | Р | Р | Р | М | Р | Р | Р | Р |
|
|
Р | Р | Р | Н | Р | Р | Р | Р | Р | Н | Н |
Р |
? | Р | ? |
|
|
Р | Р | Р | Н | - | - | - | Н | Н | Н | Н | Н | - | - | - |
|
|
Р | Р | Р | Н | Н | Н | М | М | ? | Н | Н | Н | ? | ? | - |
|
|
Р | Р | Р | М |
Н |
М | Р | Р | Р | - | Н | Р | Р | Р | Р |
|
|
Р | Р | Р | Н | Н | Н | Н | Н | Н | ? | Н | Н | ? | ? | ? |
|
|
Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | Н | ? | ? | ? |
|
|
Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
|
|
Р | Р | Р | Р | М | Н | Н | Р | Р | - | Н | Н | Н | М | Н |
Р – растворяется (>1г на 100г ![]() Н
– не растворяется (<0,1г на 100г
Н
– не растворяется (<0,1г на 100г ![]()
![]() - – в водной среде
разлагается
M – мало растворяется (от 0,1г до 1г на 100г
- – в водной среде
разлагается
M – мало растворяется (от 0,1г до 1г на 100г ![]() (С) Панарин О.В., 2001.
(С) Панарин О.В., 2001.
? – нет достоверных сведений о существовании соединения
Сильные и слабые электролиты
|
Сильные |
Слабые |
|
1. Все растворимые соли. |
1. Все труднорастворимые соли. |
|
2. Неорганические кислоты:
|
2. Неорганические кислоты:
|
|
3. Щелочи: |
3. Амфотерные основания: 4. Неамфотерные гидроксиды: 5. Органические кислоты:
6. |
Электролиз
|
Расплавов солей, оснований |
Растворов солей, гидроксидов и кислот |
|
Бескислородный анион (пример): A(+): Кислородсодержащий анион (пример): A(+): |
Li K Ca Na Mg Al Mn Zn Cr Te Ni Sn Pb H Cu Hg Ag Pt Au I группа II группа III группа I группа: K(-): II группа: K(-): III группа: K(-): Анион бескислородной кислоты (пример): A(+): Кислородосодержащий анион (пример): A(+): |
Молекулярные массы неорганических соединений
| Ионы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– | – | 62 | 94 | 153 | 56 | 40 | 102 | 152 | 72 | 160 | 71 | 81 | 80 | 232 | 223 |
|
|
18 | 35 | 40 | 56 | 171 | 74 | 58 | 78 | 103 | 90 | 107 | 89 | 99 | 98 | 125 | 241 |
|
|
36,5 | 53,5 | 58,5 | 74,5 | 208 | 111 | 95 | 138,5 | 158,5 | 127 | 162,5 | 126 | 136 | 135 | 143,5 | 278 |
|
|
81 | 98 | 103 | 119 | 297 | 200 | 184 | 267 | 292 | 216 | 296 | 215 | 225 | 224 | 188 | 367 |
|
|
128 | 145 | 150 | 166 | 391 | 294 | 278 | 408 | 433 | 310 | 437 | 309 | 319 | 318 | 235 | 461 |
|
|
63 | 80 | 85 | 101 | 261 | 164 | 148 | 213 | 238 | 180 | 242 | 179 | 189 | 188 | 170 | 331 |
|
|
34 | 68 | 78 | 110 | 169 | 75 | 56 | 150 | 200 | 88 | 208 | 87 | 97 | 96 | 248 | 239 |
|
|
82 | 116 | 126 | 158 | 217 | 120 | 104 | 294 | 344 | 136 | 352 | 135 | 145 | 144 | 296 | 287 |
|
|
98 | 132 | 142 | 174 | 233 | 136 | 120 | 342 | 392 | 152 | 400 | 151 | 161 | 160 | 312 | 303 |
|
|
62 | 96 | 106 | 138 | 197 | 100 | 84 | 234 | 284 | 116 | 292 | 115 | 125 | 124 | 276 | 267 |
|
|
78 | 112 | 122 | 154 | 213 | 116 | 100 | 282 | 332 | 132 | 340 | 131 | 141 | 140 | 292 | 283 |
|
|
98 | 149 | 164 | 212 | 601 | 310 | 262 | 122 | 147 | 358 | 151 | 355 | 385 | 382 | 419 | 811 |
Порядок заполнения электронами атомных орбиталей1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 8s |
![]()
![]()
![]()
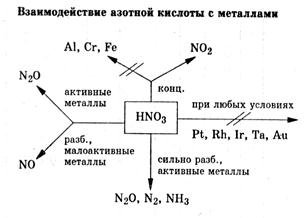
Ряд электоотрицательности неметаллов
Si, As, H, P, Se, I, C, S, Br, Cl, N, O, F
 усиление элекроотрицательности
усиление элекроотрицательности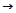
Электрохимический ряд напряжений металлов
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Version 4.0
Без разрешения автора копировать запрещается (достаточно отправить сообщение об использовании на е-mail: mailto:oleg-p@rambler.ru)