
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология и педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по информатике программированию
Краткое содержание произведений
Реферат: Научные основы школьного курса химии. методика изучения растворов
Реферат: Научные основы школьного курса химии. методика изучения растворов
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ТАМБОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
имени Г.Р. ДЕРЖАВИНА
Кафедра неорганической и физической химии
НАУЧНЫЕ ОСНОВЫ ШКОЛЬНОГО КУРСА ХИМИИ.
МЕТОДИКА ИЗУЧЕНИЯ РАСТВОРОВ.
Дипломная работа
Научный руководитель:
кандидат технических наук,
доцент
Тамбов
2001
Дипломная работа допущена
кафедрой к защите в ГАК
«_____»______________ 2001 г. протокол № _____
Зав. кафедрой _______________________________
(подпись)
Рецензент: ________________________________
________________________________
________________________________
________________________________
(Ф.И.О.)
РЕЦЕНЗИЯ
на дипломную работу ________________________________________________
на тему Научные основы школьного курса химии.
Методика изучения растворов.
Оценка
Подпись рецензента. ____________________
Дата «______»____________________ 2001 г.
М.П.
Содержание
Введение ________________________________________________________ 5
I. Научные основы преподавания химии.
Часть 1. Формирование химического языка при
обучении химии. _______________________________________ 7
Часть 2. Место эксперимента и его роль в
развитии мышления школьников. _______________________ 20
II. Методика изучения растворов. _______________________________ 36
III. Реакция взаимодействия металлов с растворами солей.
Эксперимент по коллоидным растворам. ______________________ 54
Часть 1. Реакции металлов с растворами солей. __________ 55
Часть 2. Эксперимент по коллоидным системам. _________ 58
Выводы _________________________________________________________ 64
Использованная литература ______________________________________ 65
Введение.
У любой науке, в том числе и химии свои законы, теории, свой накопленный опыт, который усваивают многие поколения школьников. То есть наука – это главным образом сокровищница накопленных знаний, и обучение, в общем, и целом можно рассматривать как процесс переноса научных знаний из учебника в голову ученика. Но в тоже время, накопленные знания – это продукт духовной деятельности, органично включающий в себя нечто живое человеческое и, следовательно, не могут быть отделимы от человека. Поэтому перенос научных знаний из учебника или головы учителя в головы учеников нельзя осуществлять механически, игнорируя познавательную активность учащегося.
Любые научные знания – это всегда результат нелегкого поиска ответов на возникшие вопросы и проблемы, выдвижения гипотез и смелых теорий; точнейшие эксперименты, завершающиеся выводами.
На современном этапе к основной задаче обучения следует отнести действительное, истинное освоение учебного материала, что возможно лишь при творческом его восприятии, а не зубрежке, вызывающей отвращение к учебе.
Чтобы решить эту проблему, необходимо использовать современные методики обучения, развивающие обучение и научить школьников «учить творчески».
Сегодня учитель вправе самостоятельно выбирать содержание, организационные формы и методы обучения. В его распоряжении альтернативные концепции химического образования, вариативные программы и учебники, в основе которых, прежде всего, лежит химический эксперимент, без которого невозможно успешное изучение химии.
Настоящая дипломная работа посвящена некоторым вопросам научных основ преподавания химии и использованию проблемного метода обучения в химическом эксперименте.
Глава 1. Научные основы преподавания химии.
Часть 1. Формирование химического языка при обучении химии.
Как в химической науке, так и в химическом образовании невозможно общение, обучение и передача химической информации без использования химического языка.
Химический язык включает три важных раздела: символику, терминологию и номенклатуру, с помощью которых обучаемый познает, обучается и передает свои мысли.
Терминология была введена в химию известным французским ученым А.Л. Лавуазье. Терминология – это совокупность терминов, употребляемых в какой- либо области науки. В химии она имеет очень большое значение и знакомство с ней осуществляется в школьном курсе химии уже в первой главе учебника 8 го класса [1,2,3]. Например, термины: отстаивание, декантация, фильтрование, фильтрат, центрифугирование, выпаривание, дистилляция и т.д.
В этой же главе закладываются основы второй составной части языка – символики, основоположником которой является Я. Берцелиус. Символика – это система условных знаков науки, условно обозначающие объекты, явления, закономерности химии. Обзорно раскрывающие их существенные признаки, связи, отношения и придающие им качественную характеристику.
Благодаря символике химический язык приобрел ряд достоинств: краткость, однозначность, точность, большие эвристические возможности. Он стал активным средством познания химии, описания его результатов, выражения наиболее важных и характерных признаков и объективных связей в химии [4].
Появление языка химических знаков, формул и уравнений вызвано внедрением в химию атомистики, которая с помощью химического языка позволяет регистрировать и закреплять результаты познания состава, структуры и химических превращений веществ.
Школьный химический язык – это язык химии, дидактически переработанный в соответствии с целями и содержанием обучения, с учетом возрастных особенностей учащихся и психологических основ его переработки [4].
Он направлен на освоение курса химии средней школы, на развитие и воспитание учащихся.
Менделеев писал, говоря о химическом языке, что «химические формулы говорят химику целую историю вещества», что химические знаки, формулы, уравнения – это «международный язык, придающий химии, кроме точности понимания, простоту и ясность, основанные на исследовании законов природы» [5].
Составление методики формирования химического языка в школе, связано с именами таких ученых, как Г.И. Гесс, Д.И. Менделеев, А.М. Бутлеров. Дальнейшее его развитие осуществлено В.Н. Верховским, Л.М. Сморгонским, С.Г. Шаковаленко, Д.М. Кирюшкиным и современными учеными.
Учитель в своей практике должен уделять особое внимание формированию химического языка. Если химический язык освоен школьниками, то химия не будет представлять для них сложности. Если не освоен, то предмет будет трудным. Поэтому формированию химического языка следует уделять особое внимание.
Рассмотрим, какие требования должны предъявляться к овладению учащимися химическим языком:
1. Усвоение качественного и количественного значения химических знаков элементов и умение правильно применять их.
2. Усвоение качественного и количественного значения химических формул, приобретение умения составлять формулы веществ по валентности, образующих их элементов. Формирование умения читать формулы, проговаривать их на слух, и применять их при истолковании состава веществ и химических процессов с точки зрения теории строения вещества. Умение производить по формулам простейшие расчеты.
3. Составление ионных и простейших электронных формул, чтение и понимание их.
4. Составление структурных формул органических и некоторых неорганических веществ, чтение и понимание их. Применение структурных формул при изложении вопросов о составе, получении и химических свойствах вещества.
5. Усвоение качественного и количественного значения уравнений химических реакций, умение составлять и читать их, производить стехиометрические расчеты.
Основу химического языка составляет терминология, введенная в науку французским ученым А. Лавуазье. Термины вводятся, формируются и развиваются на протяжении всего школьного курса. Для успешного усвоения терминологии целесообразно учить школьников умению работать с терминами, использовать составленный ими в процессе обучения терминологический словарь. Школьники должны знать значение и смысл химических и научных терминов; уметь связывать их с основными химическими понятиями, раскрывать этимологическое и смысловое значение термина, уметь его проанализировать.
Наряду с этим, школьника следует учить произношению и записи термина, раскрывать содержание термина; заменять, при необходимости, его другим, близким по смыслу и значению ( например: «сублимация» – «возгонка» ); осуществлять анализ и взаимопереходы между терминами и символами.
Как было отмечено выше, основоположником символики является
Я. Берцелиус. Символика – это наиболее специфическая часть языка химии, это система условных знаков науки, которые обобщенно, условно обозначают объекты, явления, закономерности химии, раскрывают их существенные признаки, связи, отношения, дают им качественную и количественную характеристику. Символика включает химические знаки элементов, химические формулы и химические уравнения.
Химический знак – это не только краткое название атома, но и обозначение относительной атомной массы, а следовательно и молярной массы. Химический знак имеет и качественное и количественное значение.
Рассмотрим, какие знания сообщаются школьнику о химическом знаке: исторические сведения о создании химической символики, названия и обозначения знаков, их значения и смысл.
После изучения знаков школьники должны уметь произносить, записывать и использовать знаки; осуществлять переходы от названия к знаку и обратно.
После изучения химических знаков наступает этап формирования знаний о химических формулах, являющихся отображением молекулы вещества; весовых отношений элементов вещества; указывает из каких элементов состоит вещество; сколько атомов каждого элемента входит в состав молекулы и каково их количественное отношение.
При изучении химических формул следует раскрыть их значение в химическом познании. Показать виды химических формул (эмпирические, электронные, ионные, структурные, проекционные и т.д.), их смысл, качественное и количественное выражение формулы, связь с законом постоянства состава, правила составления формул.
Школьники должны уметь составлять, читать, анализировать формулы. Определять по ним валентность и степень окисления элементов, прогнозировать реакционную способность химических связей и соединений. Устанавливать закономерность между составом и свойством вещества, его составом и строением, производить расчеты, использовать общие формулы водородных и кислородных соединений, их классов и гомологических рядов для обобщения и систематизации знаний.
Изучению химических знаков и химических формул учитель должен уделить особое внимание, так как знания о них являются ключом для успешного усвоения химических уравнений. Известно, что наибольшее число фактических ошибок, школьники допускают при составлении химических уравнений.
Химические уравнения показывают, какие молекулы вступили в реакцию и какие новые молекулы (вещества) получились в результате реакции, в каком весовом отношении реагировали молекулы и в каком весовом отношении образовались новые молекулы (вещества). Химические уравнения показывают сущность химической реакции с точки зрения атомно-молекулярной теории.
Химические уравнения показывают, что изменение состава молекул исходных веществ и образование молекул нового состава, при химической реакции, явилось следствием движения атомов, их взаимной перегруппировки в молекулах.
Наряду с этим следует показать, что химические уравнения имеют «качественное и количественное» содержание. По ним можно производить разнообразные вычисления.
При изучении химических уравнений учитель раскрывает учащимся значение уравнений в познании химии, виды уравнений, их смысл и связь с законом сохранения массы веществ, отражение в них качественной стороны реакций и количественных отношений, способы составления различных уравнений и расчетов по ним. При этом формируются следующие умения: составлять, читать, анализировать, толковать уравнения, раскрывать смысл коэффициентов, определять по уравнению тип реакции и давать ее описание. Производить расчеты по уравнениям реакций и осуществлять переходы от одного вида уравнения к другому.
Терминологию и символику дополняет химическая номенклатура. При ее изучении следует раскрыть ее значение в познании, показать виды номенклатурных систем в обучении, раскрыть роль номинальных названий в познании химии, соотношения между номенклатурной терминологией и символикой. Следует научить школьников читать, произносить, истолковывать названия ионов, веществ неорганического и органического происхождения. Извлекать из названий информацию о классе соединений, о конкретных веществах, их качественном составе и характере, составлять названия веществ по международной номенклатуре, осуществлять переход от названия вещества и наоборот. Соотносить международные, русские и тривиальные названия, составлять рациональные и систематические названия изомеров по формулам органических соединений и наоборот. Использовать номенклатуру при описании и объяснении веществ [4].
Химическая номенклатура, как и химический язык в целом, являются средством и методом передачи учителем и усвоения учащимися химических знаний. С их помощью регистрируются и закрепляются химические знания о качественном и количественном составе веществ, строении молекул и т.д. Химические знаки, формулы и уравнения используются при наблюдении химических реакций, их анализе и объяснении.
Химический язык и номенклатура являются средством и методом применения добытых знаний на практике; решения количественных, экспериментальных и других задач. В процессе обучения химический язык и номенклатура выступают как средство, с помощью которого ученики осмысливают химические процессы, предвидят новые химические факты, планируют практические действия и выполняют их. Пользуясь химическими знаниями и химическим языком, школьники могут находить путь получения вещества, демонстрируя при этом способность, разобраться в конкретной ситуации, предвидеть химические факты и планировать практические действия.
Наряду с этим, химический язык и номенклатура являются средством учета знаний учащихся и изучения развития их мышления.
С помощью химического языка и номенклатуры, учащиеся излагают свои знания о составе, химических свойствах и применении веществ, объясняют реакции с точки зрения теории строения вещества. В процессе обучения химии, должен быть достигнут свободный переход учащихся от химического языка к химическим терминам, общенаучным словам и предложениям, от них к самостоятельной постановке эксперимента, т.е. к практическим действиям.
Таким образом, роль химического языка в овладении школьниками химическими знаниями, умением и навыками чрезвычайно велика. В процессе последовательного овладения предметом, химический язык совершенствуется в тесной связи с развитием теоретических знаний, с накоплением химических фактов и усложнением химических понятий.
Для успешного формирования химического языка необходимо внедрять в школьную практику проблемные и игровые ситуации, элементы занимательности и исторические сведения, а главное дидактические средства обучения, в частности – фланеле, магнитографию и химический эксперимент.
Примеры практических заданий по формированию химического языка.
1. Проанализируйте содержание первой главы учебника [1], выпишите новые химические понятия и дайте им определения.
2. Из главы «Первоначальные химические понятия» [1], выпишите предлагаемые в ней символы химических элементов и дайте им названия.
3. В терминологический словарь выпишите формируемые в главе I [1] термины, дайте им характеристику.
4. Из перечисленных химических знаков выписать символы элементов, относящихся к металлам и дать им названия:
К, Н, Na, O, Cu, N, Fe, S, Ln.
5. Из перечисленных химических знаков элементов выписать символы элементов – неметаллов и назвать их:
C, Mg, Br, Ag, Cu, P, Al.
6. По названию химического элемента напишите его химический символ:
Никель, Фосфор, Кальций, Литий, Гелий, Магний, Хлор, Барий, Углерод.
7. Какова количественная характеристика элементов:
Кислород, Калий, Сера, Углерод, Фтор, Барий, Фосфор ?
8. Расшифруйте, что означает следующая запись:
4H, 4H2, H2, O, 5O, O2, 5O2 ?
9. Напишите: пять атомов азота; пять молекул азота; три атома хлора; пять молекул хлора.
Работа с химической формулой.
I. Качественная характеристика.
Рассмотрим на примере оксида фосфора (V).
1. Эмпирическая формула - P2O5
2. Вещество состоит из элементов: фосфора и кислорода.
3. Относится к классу оксидов, так как отвечает определению оксидов:
Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород, проявляющий степень окисления – 2.
4. Данный оксид относится к классу кислотных оксидов, так как ему соответствует ортофосфорная кислота:
P2O5 - H3PO4
II. Количественная характеристика.
1. Молекула P2O5 состоит из двух атомов фосфора и пяти атомов кислорода.
2. Определим относительную молекулярную массу оксида:
Mr(P2O5) = 2Ar(P) + 5Ar(O) = 2.31 + 5.16 = 142
3. Молярная масса оксида фосфора (V)
M(P2O5) = 142 г/моль.
4. Определим массовые доли элементов в P2O5, используя следующую формулу:
n . Ar(Э)
W(Э) = ¾¾¾¾¾¾¾ , где
Mr (вещества)
W – массовая доля элемента
n - число атомов элемента
Ar – относительная атомная масса элемента
Мr – относительная молекулярная масса вещества.
а) определим относительную молекулярную массу вещества (см. выше)
Mr(P2O5) = 142
б) расчет массовой доли фосфора:
n(P) × Ar(P) 2 × 31
W(P) = ¾¾¾¾¾¾ ; W(P) = ¾¾¾ = 0,4366 или (в долях единицы) 43,66 %
Mr(P2O5) 142
в) расчет массовой доли кислорода:
n(O) × Ar(O) 5×16
W(O) = ¾¾¾¾¾¾¾ ; W(O) = ¾¾¾ = 0,5634 или 56,34 %
Mr(P2O5) 142
W(O) можно определить и следующим образом :
W(O) = 100% - W(P) = 100% - 43,66% = 56,34%
5. Определение отношения моль атомов элементов по формуле P2O5
n(P) = 2 ; n(O) = 5; n(P):n(O) = 2:5 .
6. Определение отношения масс элементов:
P2O5 m(P) = 2×31 = 62 ; m(O) = 5 ×16 = 80 ; m(P):m(O) = 62:80 , сократим на 2
m(P):m(O) = 31:40 .
7. Определение валентности элементов по формуле P2O5
а) наименьшее общее кратное символов элементов, которые делятся на 2 и 5
равно 10.
б) число 10 делим на величину индекса каждого элемента и получаем значение валентности элемента.
V II
P2O5 ® P2O5
![]()
10
наименьшее общее
кратное
8. На ряду с этим, по валентности можно составить формулу вещества. Например, в оксиде фосфора валентность фосфора равна трем, а кислорода двум.
III II
P O
Находим наименьшее общее кратное – число, которое делиться на 3 и 2 – число 6. Это число (6) делим на соответствующие элементам значения валентностей и получаем соответствующие элементам индексы:
для фосфора 6:3 = 2;
для кислорода 6:2 = 3
и составляем формулу вещества: P2O3 .
Приведем примеры задач на расчет по формуле:
№1. Соединение некоторого элемента имеет формулу Э3О4 , а массовая доля элемента в нем 72,4%. Установите элемент [6].
Методика решения:
![]()
Дано: 1. Выразим массовую долю элемента:
Э3О4 n(Э) × Ar(Э)
W(Э)= 72,4%, W(Э) = ¾¾¾¾¾¾ ;
![]() или
0,724 Mr(Э3О4)
или
0,724 Mr(Э3О4)
Э - ? 2. Примем Ar(Э) = X, тогда
Mr(Э3О4) = 3X + 4×16 = 3X + 64 .
3. Подставим принятые обозначения в формулу
3× X
0,724 = ¾¾¾¾ ; находим Х
3×X + 64
2,172 × Х + 46,34 = 3 × Х ; 0,828 × X = 46,34 ; X= 56.
Следовательно, Ar(Э) = 56; Элемент – железо.
№2. В результате обжига на воздухе 8,0 г сульфида молибдена было получено 7,2 г оксида молибдена (VI). Установите формулу исходного сульфида молибдена [7].
Методика решения:
![]()
Дано: 1. По закону сохранения массы веществ
m(MoxSу) = 8,0 г m(Mo) до реакции = m(Mo) после реакции след-но
![]() m(MoO3) = 7,2 г n(Mo)
до реакции = n(Mo) после реакции
m(MoO3) = 7,2 г n(Mo)
до реакции = n(Mo) после реакции
MoxSу - ? 2. Определим количество вещества оксида
молибдена (VI)
m 7,2 г
n(MoO3) = ¾¾ = ¾¾¾¾¾ = 0,05 моль
M 144 г/моль
3. Определим количество вещества и массу молибдена
n(Mo) = n(MoO3) = 0,05 моль; m(Mo) = 0,05 × 96 = 4,8 г
4. Найдем массу серы и количество вещества серы
m 3,2
m(S) = m(MoxSу) – m(Mo) = 8,0 – 4,8 = 3,2 г; n(S) = ¾¾ = ¾¾ = 0,10 моль
M 32
5. Найдем отношение количеств веществ молибдена и серы
n(Mo) : n(S) = 0,05:0,10 = 1:2
Следовательно, формула сульфида молибдена: MoS2
№3. Определить массу водорода в (г), содержащегося в 3,01 × 1024 молекул метана [8].
Методика решения:
![]() Дано: Для
решения задачи необходимо последовательно
Дано: Для
решения задачи необходимо последовательно
СH4 использовать следующие формулы:
![]() N(СH4) = 3,01 × 1024 N
m
N(СH4) = 3,01 × 1024 N
m
n = ¾¾ и n = ¾¾ ;
m(H) - ? NA M
1. Находим количество вещества метана и водорода:
N(СH4)
n(СH4) = ¾¾¾¾¾¾¾ ; где NA – постоянная Авогадро, равная 6,02 × 1023
NA структурных единиц.
3,01 × 1024
n(СH4) = ¾¾¾¾¾¾ = 5 моль
6,02 × 1023
n(H) = 4n (СH4) = 4 × 5 = 20 моль атомов водорода
2. Определим массу водорода в (г):
m(H) = n(H) × M(H) = 20 × 1 = 20 г.
№4. Какова молекулярная формула углеводорода, содержащего 82,5% углерода. Плотность паров по воздуху составляет 2 [9].
Методика решения:
![]() Дано:
1. По относительной плотности паров по воздуху
Дано:
1. По относительной плотности паров по воздуху
W(C) = 82,5% расчитаем относительную молекулярную массу
Dвозд = 2 углеводорода СхНу
![]() Mr(СхНу)
Mr(СхНу)
СхНу - ? Dвозд = ¾¾¾¾¾ ; Mr(возд) = 29
Mr(возд)
Mr(СхНу) = 29 × 2 = 58 .
2. Используя формулу расчета массовой доли элемента, определим число атомов углерода:
n(C) × Ar(C) X × 12
W(C) = ¾¾¾¾¾¾ ; n(C) = X ; 0,825 = ¾¾¾ ; X = 4; n(C) = 4
Mr(СхНу) 58
3. Определим массовую долю элемента водорода и число его атомов:
W(H) = 100% - W(C) = 100 – 82,5 = 17,5%
n(H) × Ar(H) Y × 1
W(H) = ¾¾¾¾¾¾ ; n(H) = Y ; 0,175 = ¾¾¾ ; Y = 10; n(H) = 10
Mr(СхНу) 58
Следовательно, формула углеводорода: С4H10 - бутан.
№5. Установите формулу кристаллогидрата MnCl2, если известно, что при его обезвоживании массовая доля сухого остатка составила 63,63% от массы кристаллогидрата [10].
Методика решения:
![]() Дано: 1.
Процесс обезвоживания кристаллогидрата
Дано: 1.
Процесс обезвоживания кристаллогидрата
MnCl2 × Х H2O можно выразить следующей схемой:
![]() W(MnCl2)
= 63,63% t°
W(MnCl2)
= 63,63% t°
MnCl2 × Х H2O ® MnCl2 + Х H2O
MnCl2 × Х H2O - ?
Сухой остаток составит безводная соль MnCl2 , массовая доля которого 63,63%.
2. Выразим величину массовой доли сухого остатка:
Mr(MnCl2)
W(MnCl2) = ¾¾¾¾¾¾¾¾¾ ;
Mr(MnCl2 × Х H2O)
3. Рассчитаем относительные молекулярные массы безводной и водной солей:
Mr(MnCl2) = 55 + 2 × 35,5 = 126
Mr(MnCl2 × Х H2O) = 126 + 18X
4. Подставим, найденные величины в формулу массовой доли и определим значение Х:
126
0,6363 = ¾¾¾¾¾ ; 80,17 + 11,45 X = 126; 11,45 X = 45,83; X = 4 .
126 + 18 Х
Следовательно, формула кристаллогидрата: MnCl2 × 4H2O
№6. Массовая доля серебра в соли предельной одноосновной органической кислоты составляет 70,59%. Написать молекулярную формулу кислоты, если известно, что она состоит из углерода, водорода и кислорода [11].
Методика решения:
![]() Дано:
Общая формула соли предельной одноосновной орга-
Дано:
Общая формула соли предельной одноосновной орга-
W(Ag) = 70,59% нической кислоты имеет следующий вид:
![]()
C n H2n+1 COOH - ? C n H2n+1 COOAg
1. Выразим массовую долю серебра в общем виде:
n(Ag) × Ar(Ag)
W(Ag) = ¾¾¾¾¾¾¾¾¾¾ ;
Mr(C n H2n+1 COOAg)
2. По формуле рассчитаем относительную молекулярную массу соли:
Mr(C n H2n+1 COOAg) = 12n + 2n + 1 +12 + 2 × 16 + 108 = 14n + 153 .
3. Сведем данные в формулу массовой доли:
1 × 108
0,7059 = ¾¾¾¾¾ ; 9,88n + 108 = 108; n=0
14n + 153
Следовательно: 14n – превращается в 0 и форму соли HCOOAg, а формула кислоты HCOOH .
Часть 2. Место эксперимента и его роль в развитии мышления
школьников.
Одним из важнейших словесно – наглядных и словесно – наглядно – практических методов обучения является химический эксперимент. Он играет особую роль в обучении химии. Химический эксперимент знакомит учащихся не только с самими явлениями, но и методами химической науки. Он помогает вызвать интерес к предмету, научить наблюдать процессы, освоить приемы работы, сформировать практические навыки и умения.
Следует отметить, что проблема химического эксперимента в методике обстоятельно исследована. Большой вклад в нее внесли такие ученые как В.Н. Верховский, В.В. Фельдт, К.Я. Парменов, В.В. Левченко, В.С. Полосин, Д.М. Кирюшкин, Л.А. Цветков и другие.
К.Я. Парменов[13] не только уделял внимание технике эксперимента, но и методике его включения в учебный процесс. Он отмечал, что при провидении
демонстрационного эксперимента необходимо подготовить учащихся к наблюдению опыта и умело руководить этими наблюдениями. Особенно детально разработана эта проблема В.С. Полосиным [14,15]. Он исследовал эффективность различных способов приложения химического эксперимента, разработал методику комплексного использования химического эксперимента в сочетании с другими средствами обучения.
Химический эксперимент можно разделить на два вида: демонстрационный и ученический. Демонстрационный эксперимент относится к словесно – наглядным методам обучения.
Демонстрационным называют эксперимент, который проводится в классе учителем, лаборантом или иногда одним из учащихся [16].
Демонстрационный эксперимент, проводится в соответствии с государственной программой по химии для средней школы, по каждой конкретной изучаемой теме курса.
Демонстрационный эксперимент дает возможность учителю формировать интерес к предмету у школьников, научить их выполнять определенные операции с веществом; приемам лабораторной техники.
К требованиям, предъявляемым к демонстрационному эксперименту, следует отнести:
- Наглядность. Эксперимент следует проводить в цилиндрах, стаканах, чтобы химическое явление можно было наблюдать с любой точки класса. Стол преподавателя не должен быть загроможден лишними предметами, чтобы были видны руки учителя. Можно использовать подъемный столик или кодоскоп.
- Простота. Прибор, в котором демонстрируют эксперимент, не должен содержать лишних деталей и нагромождений, чтобы внимание обучаемых не отвлекалось от химического процесса. Не следует увлекаться эффектными опытами, так как менее эффектные опыты не будут пользоваться вниманием.
- Безопасность эксперимента. Учитель несет ответственность за безопасность учащихся, поэтому в кабинете должны находиться средства пожарной безопасности, вытяжной шкаф для проведения работ с вредными и пахучими веществами, средства для оказания первой помощи . реактивы для проведения опытов должны быть проверены заранее; посуда для эксперимента – чистой. При проведении опасных опытов следует использовать защитный экран.
- Надежность. Опыт всегда должен удаваться, и с этой целью техника эксперимента перед его проведением должна быть тщательно отработана, все операции должны быть четкими, уверенными; недопустима неряшливость в оформлении опыта. Учитель должен следить за своим внешним видом и поведением. В случае неудачи, необходимо выяснить ее причину, и опыт на следующем уроке повторить.
- Необходимость объяснения эксперимента. Любой опыт должен сопровождаться словом учителя. Возникающие паузы можно использовать для организации диалога со школьниками, выяснения условий проведения эксперимента и признаков химических реакций.
( условия – это то, что необходимо для того, чтобы реакция началась и протекала;
признаки – это то, по чему судят о том, что реакция протекает или уже закончилась ).
Следует помнить, что опыт – это метод исследования, поэтому лучше провести меньшее их количество, но каждый опыт должен быть объяснен.
Методика демонстрации опытов:
1. Необходима постановка цели опыта – для чего проводится опыт, что необходимо понять в результате наблюдений за экспериментом.
2. Следует описать прибор, в котором проводится опыт; условий, в которых он проводится; дать характеристику реактивам.
3. Организовать наблюдения за опытом учащихся для выявления признаков реакции и проведения анализа.
4. Помочь школьникам сделать соответствующие выводы и теоретическое обоснование.
Как любой учебный процесс, демонстрационный эксперимент решает три задачи: образовательную, воспитательную, развивающую, суть которых состоит в следующем:
Образовательная цель – получить информацию о протекании химической реакции, свойствах веществ и методах химической науки;
Воспитательная – сформировать убеждение, что опыт – инструмент познания, что мир познаваем.
Развивающая – развитие наблюдательности, умение анализировать явления, факты; делать обобщения и выводы.
В основе словесно – наглядно – практического метода лежит практическая деятельность учащихся, которая не может осуществляться без руководящего слова учителя и без использования элементов наглядности. Главный путь этого метода – самостоятельная работа школьников. Ее формы: коллективная, групповая и индивидуальная. Виды самостоятельной работы: ученический эксперимент, решение химических задач и упражнений, работа с литературой; выполнение творческих заданий; письменные работы контрольного характера и т.д..
Самостоятельная работа – это наиболее важный путь освоения учащимися новых знаний, умений и навыков в освоении методов химической науки.
Образовательная цель самостоятельной работы – освоение методов химической науки, экспериментальными умениями; умениями работать с учебником, литературой; производить расчеты; пользоваться химическим языком.
Воспитательная цель - формирование черт личности школьника, трудолюбия, настойчивости, товарищеской взаимопомощи.
Развивающая цель – развитие самостоятельности, интеллектуальных умений, умение анализировать явления и делать выводы.
Самостоятельная работа может быть источником знаний, способом их проверки, совершенствования и закрепления знаний, умений и навыков. Этот вид деятельности учащихся формируется под контролем учителя.
Как показано выше, ученический эксперимент – вид самостоятельной деятельности учащихся, запланированный в государственной программе по химии. Это способ проверки истинности, приобретенных знаний; способствующий более глубокому пониманию материала, усвоению знаний. Ученический эксперимент можно подразделить на лабораторные опыты и практические работы.
Лабораторные опыты проводятся школьниками во время объяснения учителем нового материала. Для этого ученические столы оснащаются необходимым оборудованием и реактивами. Учитель руководит выполнением эксперимента, оформлением отчета. Лабораторный опыт – источник знания, к нему предварительно школьники не готовятся. В тетрадях делается соответствующие записи.
Практические работы проводятся после изучения определенной темы или раздела. Это уроки контролирующие знания, умения и навыки. К ним готовятся заранее по инструкции, изложенной в учебнике. Перед допуском к выполнению практической работы учитель проводит инструктаж по технике безопасности и выполнению работы. Объясняются наиболее сложные моменты в работе. Работа выполняется в течении 45 минут, оценки выставляются каждому ученику. Отчет оформляется в специальных тетрадях, после проверки, проводится анализ.
Ученический эксперимент должен удовлетворять следующим требованиям [4 с.102-109]:
1. Учащиеся должны понимать суть опыта и знать последовательность выполнения отдельных операций по инструкции.
2. Соблюдать дозировку реактивов и правила работы с ними.
3. Уметь собирать приборы по рисунку и правильно работать с ними.
4. Неукоснительно выполнять правила техники безопасности при обращении с оборудованием, приборами и реактивами.
5. Четко оформлять отчет о проведенной экспериментальной работе.
Выполняя химические работы, самостоятельно, или наблюдая за их демонстрационной постановкой ученики узнают о природе вещества, устанавливают взаимосвязи между ее строением и свойствами.
В настоящее время, совершенствование школьного химического эксперимента, в основном, заключается в модернизации приборов, аппаратов, создания оборудования для работы с малыми количествами и, к сожалению, в меньшей степени оно нацелено на разработку принципиально новых химических опытов, которые дали бы возможность применять на уроках проблемные и исследовательские формы организации учебной деятельности школьников.
Известно, что положительные результаты в развитии творческих способностей школьников возможны при систематическом применении в обучении проблемного и исследовательского подходов. Однако методически это трудная задача, решать которую необходимо.
Детальная разработка методики проведения проблемного эксперимента поможет учителю в организации мыслительной деятельности учащихся.
Широко используемый объяснительно – иллюстративный метод обучения, не дает возможности учителю добиться прочного усвоения учениками знаний и умений. Проникающее в современную школу развивающее обучение, направлено на создание учителем проблемных ситуаций и самостоятельное овладение учениками новыми знаниями, поэтому меняется и роль учителя. Если раньше он выполнял в основном роль информатора знаний, то в настоящее время он должен управлять процессом обучения.
В проблемном обучении (развивающем обучении) все учащиеся включаются в процесс решения проблем. Проблемные ситуации должны организовываться систематически, что способствует развитию логического мышления учащихся, их творческих способностей, интересам к учению.
Классификация проблемных ситуаций приводится в книге Малафеева Р.И. [17]:
- неожиданность
- конфликт
- предположение
- опровержение
- несоответствия
- неопределенности.
Все эти ситуации, на наш взгляд, можно выразить как возникшие у
школьников противоречия, с имеющимися знаниями, которые следует разрешать выдвижением гипотезы и ее решением.
Выполняя проблемные задания, ученик должен активно и непосредственно участвовать в поиске и приобретении новых знаний и овладением новыми способами деятельности.
Рассмотрим возможности проблемного метода обучения на примере темы «Гидролиз», изучаемая в разделе «Теория электролитической диссоциации», курса химии 9-го класса.
Проблемный урок по теме «Гидролиз солей».
Цели урока:
Образовательная: Закрепить у школьников знания теории электролитической диссоциации, умение разделять вещества н а электролиты и не электролиты, определять характер среды по окраске индикатора. Сформировать знания о гидролизе, как особом свойстве солей. Доказать влияние состава соли на направление реакции, и привести учащихся к выводу о смещении равновесия диссоциации молекул воды, за счет связывания одного из ее ионов ионами соли. Сформировать умение по составу соли (ее природе) прогнозировать реакцию среды.
Воспитательная: Через проблемный метод обучения раскрыть перед учениками научный путь познания через доказательство гипотезы, способствовать переходу знаний в убеждения. Посредством эксперимента привить навыки трудолюбия, бережного отношения к реактивам, к природе, эстетические качества.
Развивающая: На примере свойств солей, различной природы, их отношение к воде, продолжить развитие умений наблюдать, сравнивать изучаемые явления, выявлять причинно – следственные связи, делать соответствующие выводы.
Тип урока:
По дидактической цели – формирование новых знаний.
По способу организации – проблемный.
Методы обучения:
Основной – проблемный.
Частные методы и методические приемы:
- преподавание; фронтальная беседа, воспроизводящая беседа с использованием демонстрационного эксперимента.
- Учения; эвристическая беседа, лабораторные опыты.
Средства наглядности: таблица растворимости.
Оборудование для эксперимента: штатив с пробирками, растворы лакмуса и фенолфталеина, растворы солей; хлорида натрия, карбоната натрия, хлорида аммония, ацетата аммония.
Литература:
1. Программа по химии для средней школы. М. Из-во «Дрофа». 1999. с.34
2. Ф.Г. Фельдман, Г.Е. Рудзитис. Химия. 9-й класс. М. Просвещение. 1999.с.18-20
3. Н.С. Ахметов. Актуальные вопросы курса неорганической химии. М. Просвещение. 1991.с.176-180
Межпредметные связи:
Физика – заряд ионов.
Биология – процесс гидролиза в организме человека; использование гидролиза при внесении удобрений в почву.
Внутрипредметные связи:
Теория строения вещества, теория электролитической диссоциации, свойства кислот и оснований, их действие на индикаторы, понятия электролит, не электролит.
Структурные элементы урока:
1. Восстановление опорных знаний.
|
(время 5 минут) Фронтальная беседа: 1. Дайте определение электролитической диссоциации. |
Деятельность ученика Ученик А. Электролитической диссоциацией называется распад электролита на ионы при растворении в воде или рас плавлении. |
|
2. Какие вещества называются электролитами? 3. Дайте определение не электролитам. |
Ученик Б. Электролиты – вещества, обладающие ионной проводимостью. Не электролиты – это вещества, не обладающие ионной проводимостью. |
|
4. Приведите примеры: - Электролитов - Не элекролитов |
Ученик В. - соли: NaCl; K2SO4; Al(NaO3)3 и т.д. кислоты: НСl; H2SO4; HNO3; HJ. щелочи: NaOH; LiOH; Ba(OH)2 - органические вещества, концентрированные NH4OH, уксусная кислота (ледяная), кристаллические соли, сахар кристаллический и раствор сахара и т.д. |
| 5. Перечислите, в каких случаях реакции между растворами – электролитами идут до конца. |
Ученик Г. Реакции между электролитами идут до конца если: 1. Выпадает осадок. 2. Выделяется газ. 3. Образуются молекулы воды или какого либо другого слабого электролита. |
2. Формирование знаний, умений, навыков.
| Деятельность учителя | Деятельность ученика | ||||||||||||||||||||||||||||||||||||
|
(время 25 минут) Запишите тему урока: «Гидролиз солей» Вспомните, какую окраску будут иметь индикаторы в дистиллированной воде: - лакмус - фенолфталеин проводим эксперимент, доказывающий рассуждения учеников. Как изменится окраска этих индикаторов, если к их водному раствору прилить раствор кислоты (проводим эксперимент). Почему окраска индикаторов изменилась? ПРАВИЛЬНО. |
Ученик А. Лакмус – фиолетовую, Фенолфталеин – бесцветную. Ученик Б. Окраска лакмуса станет красной, а фенолфталеин останется бесцветным. В дистиллированной воде концентрация ионов Н+ и ОН- одинакова и среда поэтому нейтральна. Если прилить раствор кислоты, создается избыток катионов водорода Н+, которые определяют кислую среду, и окраска индикатора поэтому изменяется. |
||||||||||||||||||||||||||||||||||||
|
В две пробирки нальем дистиллированную воду и добавим: - в первую пробирку лакмус, - во вторую фенолфталеин. Среда нейтральная. Затем в обе пробирки добавим раствор щелочи NaOH. Какие изменения мы наблюдаем? Дайте объяснения. ПРАВИЛЬНО. |
Ученик В. Лакмус изменил окраску с фиолетовой на синюю, а фенолфталеин на малиновую. При добавлении к дистиллированной воде щелочи, в растворе создается избыток ионов ОН-, определяющих щелочную среду и окраска индикатора изменяется. |
||||||||||||||||||||||||||||||||||||
|
Итак, какой можно сделать вывод на основании проведенного эксперимента: 1. В нейтральной среде концентрация ионов Н+ и ОН- одинакова, поэтому лакмус имеет фиолетовую окраску, а фенолфталеин – бесцветную. 2. В кислой среде имеется избыток ионов Н+, поэтому лакмус приобретает красную окраску, а фенолфталеин остается бесцветным. 3. В щелочной среде имеется избыток гидроксид ионов ОН-, поэтому лакмус изменяет окраску на синюю, а фенолфталеин становится малиновым. |
|||||||||||||||||||||||||||||||||||||
|
Почему? ПРАВИЛЬНО. Ваши рассуждения подтвердим экспериментом. Прильем к раствору соли в первую пробирку раствор лакмуса, во вторую раствор фенолфталеина. Действительно среда в обеих пробирках нейтральная. Нальем в две пробирки раствор карбоната натрия. Как вы думаете, будет ли изменяться окраска индикаторов в растворе этой соли? Проделаем эксперимент. Вы видите, что в первой пробирке лакмус изменил окраску на синюю, а во второй фенолфталеина на малиновую. (У школьников возникло противоречие с имеющимися знаниями – учителем создана проблемная ситуация, которую следует решить.) Следовательно, раствор Na2CO3 имеет щелочную среду. Кто может дать объяснение этому факту?
Это правильно. Но попробуйте объяснить появление избытка ионов ОН- в растворе соли. Затрудняетесь? Давайте вспомним, из чего состоит раствор? Что в данном случае является растворителем и растворенным веществом? Подумайте еще раз, как объяснить избыток гидроксид ионов в растворе Na2CO3 ? Проводим опыт: наливаем в две пробирки воду и испытываем ее индикатором. Изменилась ли окраска индикатора? Правильно, т.е. концентрация ионов водорода и гидроксид-ионов находится в равновесном состоянии. Напишите уравнение диссоциации воды. Ребята, процесс диссоциации воды – равновесный процесс, поэтому это равновесие можно сдвигать в ту или иную сторону. Для сдвига равновесия требуются определенные условия. Как вы думаете, в нашем примере, что может оказать влияние на сдвиг равновесия диссоциации воды? Выдвижение гипотезы и ее доказательство. Итак, нам необходимо выяснить, почему изменилась окраска индикаторов в растворе карбоната натрия. Напишите уравнение диссоциации соли Na2CO3.
Выясним природу соли. Правильно. Как вы думаете, какие частицы соли могут связывать частицы воды и смещать равновесие ее диссоциации? Напишем схему реакции: CO32– + НОН ® НCO3– + ОН– Среда щелочная Это краткое ионное уравнение выражает сущность процесса реакции соли с водой. Запишите уравнение в молекулярном виде. Проверим наше рассуждение на другом примере. В две пробирки нальем раствор хлорида аммония и прильем к ним: - лакмус - фенолфталеин Какие признаки реакции мы наблюдаем? Какой можно сделать вывод из этого опыта? Напишите уравнение диссоциации соли NH4Cl, определите природу соли.
Какие частицы, на ваш взгляд, могут смещать равновесие диссоциации воды? Напишите уравнение реакции: NH4+ + НОН ® NH4OH + Н+ среда кислая Наши рассуждения совпадают с результатами опытов, следовательно, выдвинутая вами гипотеза, что частицы соли, связывая частицы воды, смещают равновесие диссоциации воды и в результате этого накапливаются ионы, определяющие среду. Запишите уравнение реакции в молекулярном виде. В две пробирки нальем раствор соли CH3COONH4 – ацетат аммония, и прильем в первую – лакмус, а во вторую – фенолфталеин. Какие изменения мы наблюдаем? Напишем уравнение диссоциации соли: CH3COONH4 « NH4+ + CH3COO– Какова природа соли? Давайте выясним, почему индикаторы показали нейтральную среду. Напишем уравнения реакций: NH4+ + НОН « NH4OH + Н+ Слабый электролит CH3COO– + НОН « CH3COOН + ОН– Слабый электролит Или в общем виде: NH4++CH3COO–+НОН « NH4OH+CH3COOН Среда нейтральная В молекулярном виде: CH3COONH4 + НОН « CH3COOН + NH4OH Вернемся с вами к первому опыту с раствором NaCl, и подумаем, почему и в этом растворе среда нейтральная? Напишите уравнение диссоциации соли: И воды: На основании приведенной записи, какой можно сделать вывод? Итак, какой общий вывод можно сделать? Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. Na+ + Cl– + НОН « Na+ + ОН– + Н+ + Cl– Равновесие реакции смещено в сторону слабого электролита – Н2О, следовательно возможна обратная реакция нейтрализации, а прямая реакция не идет. NaOH « Na+ + ОН– HCl « Н+ + Cl– Реакция в этом случае не идет. Правильно. Сегодня мы с вами познакомились с особыми свойствами солей, которое называется гидролизом. Запишите в тетрадь определение: |
Ученик Г. Лакмус – фиолетовую, Фенолфталеин- бесцветную. При диссоциации соли NaCl « Na+ + Cl- ионов Н+ и ОН-, определяющих среду, не образуется, поэтому среда должна быть нейтральной. Нет Да (правильного объяснения дать не могут) Это может произойти, если в растворе в избытке появляются ионы ОН-. Раствор включает в себя растворитель и растворенное вещество.
Растворитель - вода, а растворенное вещество – соль. Вода, диссоциируя, дает протоны водорода и гидроксид ионы. Нет, так как концентрации ионов Н+ и ОН-, одинаковы. НОН « Н+ + ОН-
Наличие соли.
Na2CO3 « 2Na+ + CO32– Cсоль образована сильным основанием (NaOH) и слабой кислотой (H2CO3). Ионы Na+ не могут связывать частицы ОН- , так как NaOH сильный электролит и может существовать в растворе лишь в виде ионов. Карбонат-ионы связывают Н+ с образованием мало диссоциирующего гидрокарбонат-иона НCO3–. При этом в растворе в избытке накапливаются ионы ОН– , определяющие щелочную среду. Na2CO3 + НОН ® NaHCO3 + NaOH Раствор лакмуса изменил окраску на красную, а фенолфталеин остался бесцветным. Раствор хлорида аммония имеет кислую среду. NH4Cl « NH4+ + Cl– Соль образована слабым основанием (NH4OH) и сильной кислотой (HCl). Ионы хлора Cl– не могут сместить равновесие диссоциации воды, т.к. HCl сильный электролит и существует только в виде ионов. NH4+ ионы, свяжут гидроксид-ионы в слабый электролит NH4OH, и в свободном виде будут находиться катионы водорода, которые и определяют кислую среду. NH4Cl + НОН ® NH4OH + HCl Окраска индикаторов не изменилась. Соль образована слабым основанием (NH4OH) и слабой кислотой (CH3COOН). Очевидно частицы соли NH4+ свяжут ионы воды ОН–, а частицы CH3COO– свяжут Н+, поэтому частиц, определяющих среду, в свободном виде не будет и среда будет нейтральная. Концентрация ионов Н+ и ОН– находятся в равновесии и среда будет нейтральная. NaCl « Na+ + Cl– HOH « Н+ + ОН– NaCl – соль, образованная сильным основанием (NaOH) и сильной кислотой (HCl). Если предположить, что ионы Na+ свяжут ионы ОН–, то образуется сильный электролит NaOH, который существует в виде ионов Na+ и ОН–, а HCl так же сильный электролит, диссоциирующий на ионы Н+ и Cl–. Ионы, определяющие среду Н+ и ОН–, находятся в растворе в равных количествах, и среда будет нейтральной. Соли могут реагировать с водой, связывая частицы воды. В зависимости от природы соли, среда может быть нейтральная, щелочная или кислая. |
||||||||||||||||||||||||||||||||||||
|
Гидролиз – реакция обмена между солью и водой, в результате которой наблюдается сдвиг равновесия диссоциации молекул воды, приводящий к –накоплению в растворе избытка ионов водорода или гидроксид ионов, меняющих реакцию среды. |
|||||||||||||||||||||||||||||||||||||
|
Вспомните, какой характер имеет среда при гидролизе: 1) Соли, образованной сильным основанием и слабой кислотой? 2) Соли, образованной слабым основанием и сильной кислотой? 3) Соли, образованной слабым основанием и слабой кислотой? 4) Что можно сказать о взаимодействии с водой солей, образованных сильным основанием и сильной кислотой? Ответ правильный. |
Среда щелочная. Среда кислая. Среда нейтральная, или близкая к ней. Гидролиз идет полностью до конца. В этом случае реакция не идет, т.е. эти соли гидролизу не подвергаются. |
||||||||||||||||||||||||||||||||||||
3. Формирование способов умственных и практических действий с новыми знаниями.
| Деятельность учителя | Деятельность ученика | |||
|
(время 15 минут) Мы с вами выдвинули гипотезу и доказали ее. Теперь давайте ее подтвердим на других примерах. Перед вами на столе находится растворы следующих солей: KJ; K2S; AlCl3; (NH4)2S. С помощью индикатора, определите среду каждого раствора, дайте характеристику природе соли. Результаты сведите в следующую таблицу: |
||||
|
Соль |
Природа соли |
Среда |
Механизм процесса |
|
| KJ | Образована сильным основанием и сильной кислотой | нейтральная |
KJ « K+ + J– KOH « K+ + OH– HJ « H+ + J– |
|
|
K2S |
Образована сильным основанием и слабой кислотой | щелочная |
K+ + J– + НОН « K+ + OH– + H+ + J– ¬¾¾¾¾ K2S « 2K+ + S2– S2– + HOH « HS– + OH– K2S + HOH « KHS +KOH |
|
|
AlCl3 |
Образована слабым основанием и сильной кислотой | кислая |
AlCl3 « Al3+ + 3Cl– Al3+ + НОН « Al(OH)2+ + H+ AlCl3 + НОН « Al(OH)Cl2 + HCl |
|
|
(NH4)2S |
Образована слабым основанием и слабой кислотой | нейтральная |
(NH4)2S « 2NH4+ + S2– 2NH4+ + S2– + HOH « NH4OH + H2S (NH4)2S + 2HOH « 2NH4OH + H2S |
|
Задание на дом:
Ф.Г. Фельдман, Г.Е. Рудзитис. Химия. 9-й класс. М. Просвещение. 1999.с.18-20
§ 6, упражнения 1, 2, 3, 8 и подготовить ответы на следующие вопросы:
1) Почему не подвергается гидродлизу хлорид калия?
2) Почему в таблице растворимости солей в некоторых случаях стоят прочерки?
3) Как определить гидролизуется или нет данная соль?
4) Можно ли применить принцип Ле Шателье в случае реакции гидролиза?
5) Используется ли гидролиз в быту?
6) Возможны ли случаи гидролиза в природе?
7) О чем должен подумать агроном, прежде чем внести удобрения в почву?
Практическая часть.
1. Напишите уравнение реакций взаимодействия с водой следующих солей:
СaC2; Al4C3; Ca3N2; Mg3P2; CaH2; NaH.
Объясните причину этого процесса, по возможности определите характер среды.
2. В раствор сульфата меди внесите небольшой кусочек металлического лития и объясните причину образования осадка черного цвета.
3. В демонстрационный штатив поместите две пробирки с растворами хлорида магния, хлорида железа (III). В каждую из пробирок поместите по кусочку лития. Проанализируйте наблюдаемые явления и сделайте выводы.
4. В раствор хлорида меди (II) внесите тщательно зачищенный кусочек каль- ция. Опишите наблюдаемые явления.
5. В демонстрационный штатив поместите пробирку с раствором хлорида железа (III) и внесите зачищенный кусочек кальция. Опишите наблюдение и сравните их с опытом (1) и (4) . Дайте объяснения результатам эксперимента.
6. Проведите опыты по взаимодействию магния и алюминия с растворами солей:
а) В пробирку налейте примерно 15 мл раствора сульфата железа (III) и внесите магний.
б) В две пробирки налейте по 15 мл раствора сульфата меди (II) и в каждую внесите кусочек алюминия. Наблюдайте за ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете?
Проведите анализ опытов а) и б).
Глава 2. Методика изучения растворов.
Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего во взаимосвязи этой темы со многими курсами химических дисциплин, а так же межпредметные связи ее с биологией, географией, физикой и другими дисциплинами.
Первые сведения о воде школьники получают еще в начальной школе при изучении природоведения и географии, а более детально знакомятся со свойствами воды, растворимостью и растворами в курсе химии 8-го класса.
Проведем анализ литературных данных по изучаемому вопросу. Так в работе [18] рассматривается методика проведения двух лабораторных уроков по теме: «Растворимость веществ в воде».
На первом уроке учитель сообщает учащимся, что многие газы, жидкости и твердые вещества, при контакте с водой растворяются в ней. Из курса физики учащимся известно, что молекулы веществ находятся в непрерывном движении. Этим и объясняется явление диффузии – самопроизвольного взаимопроникновения, приведенных в соприкосновение, различных веществ. Далее говорится о том, что если положить в цилиндр с водой кристаллы дихромата калия, то через некоторое время вокруг кристаллов вода окрасится в оранжевый цвет. Невидимые частицы дихромата калия под влиянием молекул воды оторвались от кристаллов и диффундировали в воде. Диффузия происходит медленно, но в конце концов получается однородный раствор. Затем предлагается ответить на вопрос: можно ли ускорить процесс растворения? Для получения ответа учащиеся проделывают следующий лабораторный опыт: в одну пробирку они помещают немного поваренной соли крупного помола, а в другую – сильно измельченную. Затем в обе пробирки добавляют одинаковый объем воды. Учащиеся наблюдают, что соль мелкого помола растворяется быстрее, чем крупного. На основе этого опыта они делают вывод: процесс растворения ускоряется при измельчении вещества. Чем же это объясняется? Тем, что при измельчении вещества увеличивается поверхность соприкосновения его с жидкостью. Далее учащиеся сравнивают растворение различных веществ в воде. При этом они выполняют следующий опыт. В четыре пробирки насыпают равные порции сульфата кальция, сульфата бария, алюмокалиевых квасцов, хлорида натрия. Во все пробирки наливают объем воды. Учащиеся наблюдают, что сульфаты бария и кальция как будто совсем не растворяются, квасцы растворились частично, а хлорид натрия практически полностью. Затем ставится перед учащимися вопрос: можно ли все-таки добиться растворения сульфата бария, сульфата кальция и квасцов? Учащиеся предлагают нагреть пробирки, в которых они растворяли указанные вещества. Выполнив эту операцию, они отмечают, что квасцы растворились, а сульфаты бария и кальция нет. На основе этого учащиеся приходят к выводу, что повысив температуру, все-таки можно увеличить растворимость веществ. Для подтверждения того, что сульфаты бария и кальция полностью не растворимы, учащиеся фильтруют через небольшие фильтры растворы с данными солями и несколько капель каждого фильтрата выпаривают на жестяной пластинке. При выпаривании капля сульфата бария на пластинке никакого следа не оставляет, а в случае с сульфатом кальция, на пластинке в небольшом количестве появляется белый налет.
Проведенный комплекс опытов дает возможность сделать вывод о том, что по растворимости в воде вещества делятся на растворимые, малорастворимые и нерастворимые [18].
Учитель демонстрирует учащимся таблицу растворимости веществ в воде и объясняет, как ею пользоваться. После этого они записывают в тетрадь определение растворимости.
Далее от качественной характеристики учитель переходит к количественной. Он предлагает учащимся проверить, насколько хорошо растворима поваренная соль. В пробирку с раствором поваренной соли из предыдущего опыта учащиеся добавляют примерно столько же поваренной соли, сколько было взято ранее. Они взбалтывают пробирки с поваренной солью и наблюдают, что новая порция соли полностью уже не растворяется. При нагревании этого раствора наблюдается тот же эффект. Таким образом, учитель подводит учащихся к понятию “насыщенный раствор” и даёт его определение[18].
Те же операции учащиеся проделывают с квасцами. В результате они убеждаются, что в такой же порции воды при нагревании квасцов растворимость больше, чем поваренной соли. Учащиеся делают вывод: нагревание влияет на растворимость квасцов значительно сильнее, чем на растворимость поваренной соли. Зависимость растворимости солей от повышения температуры определяется природой растворяемого вещества. Изменение растворимости некоторых видов с изменением температуры наглядно показывают кривые растворимости. Учитель демонстрирует график кривых растворимости и разъясняет учащимся, как им пользоваться, раскрывает смысл коэффициентов растворимости, т.е. рассматривает количественную характеристику растворимости.
На втором уроке [18], учащиеся решают экспериментальную задачу: установите экспериментальным путем количественную зависимость растворимости нитрата калия от температуры. Составьте план определения коэффициента растворимости нитрата калия при температуре 20, 30, 40, 50° С и осуществите его в лаборатории, имея необходимое оборудование. Используя ваши данные, начертите график зависимости растворимости нитрата калия от температуры, предварительно обсудив с учителем план решения данной экспериментальной задачи. Учащиеся последовательно выполняют следующие операции: взвешивают, пустую фарфоровую чашку – m1 в колбе на 50-100 мл. Готовят в 30-50 мл воды концентрированный раствор нитрата калия при температуре на 5-10° С больше, чем заданная, и следя за показанием термометра, медленно охлаждают раствор до заданной температуры (на дне колбы должны выпадать кристаллы). Быстро отливают во взвешенную чашку 5-10 мл раствора (выпавшие кристаллы должны остаться в колбе). Взвешивают чашку с раствором, предварительно охладив его до комнатной температуры (на дне чашки появляются кристаллы нитрата калия) – m2. Осторожно выпаривают раствор досуха, охлаждают чашку с оставшимся в ней нитратом калия и взвешивают – m3. Оставшийся в колбе раствор можно вновь нагреть до растворения выпавших кристаллов, охладить до другой, заданной температуры и повторить все операции.
Расчет осуществляется следующим образом:
1. Масса отлитого раствора: m2 – m1 = m4(г)
2. Масса сухого остатка нитрата калия: m3 – m1 = m5(г)
3. Масса испарившейся воды: m4 – m5 = m6(г)
4. Коэффициент растворимости нитрата калия при данной температуре (растворимостью соли в 100 г воды): в m6(г) H2O растворяется m5(г) KNO3; в 100 г H2O растворяется Х(г) KNO3.
Составляем пропорцию и находим Х:
100 × m5
Х = ¾¾¾¾¾¾ .
m6
Одна из важнейших форм проведения экспериментальных занятий, впервые разработанная В.Н. Верховским – лабораторный урок. Задачей такого лабораторного урока может быть проведение небольшой исследовательской экспериментальной работы , направленной на эвристический вывод определенных положений [18].
Оригинальный химический эксперимент предлагается авторами [19], как прекрасное средство для обобщения материала по курсу химии. Так первая серия включает превращение по химии иона Fe3+. В пробирку помещают 30 капель 0,1М раствора хлорида железа (III) FeCl3 и пять капель 2М раствора карбоната натрия Na2CO3. В результате образования нестойкой кислоты и нерастворимого гидроксида железа, происходит необратимый гидролиз соли:
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl
К полученному осадку, кирпично-красного цвета, добавляют семь капель 3М раствора хлороводорода HCl. В результате связывания оставшихся карбонат ионов и растворения осадка раствор становиться прозрачным:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Добавление четырех капель 0,05М раствора тиоцината калия KSCN, приводит к окрашиванию раствора в кроваво-красный цвет в следствии образования комплексного иона:
Fe3+ + 6SCN– = Fe(SCN)63–
При добавлении 20 капель 1М раствора фторида натрия NaF раствор обесцвечивается вследствие образования более стабильного фторидного комплекса:
Fe(SCN)63– + 6F– = FeF63– + 6SCN–
Последующее добавление 10 капель 1М раствора гидроксида натрия NaOH, разрушает комплексный ион и приводит к выпадению кирпично-красного осадка:
FeF63– + 3ОН– = Fe(OH)3↓ + 6F–
При добавлении к полученному раствору двух капель 1М раствора сульфида натрия Na2S происходит восстановление трехвалентного железа в двухвалентное, а так же переход железа из одной осажденной формы (гидроксид) в другую – более стойкую (сульфид). В пробирке образуется осадок черного цвета.
Fe(OH)3 + 2S2– = FeS↓ + S↓ + 3ОН–
Вторая серия включает превращение по химии иона меди Cu2+. Для этого в пробирку наливают 20 капель 0,1М раствора сульфата меди (II) CuSO4 происходит необратимый гидролиз и образуется осадок синего цвета:
CuSO4 + Na2CO3 + H2O = Cu(OH) 2↓ + CO2↑ + Na2SO4
Далее пять капель раствора хлороводорода HCl вызывают растворение выпавшего осадка:
Cu(OH) 2 + 2Н+ = Сu2+ + 2H2O
Добавляем в пробирку пять капель 1М раствора иодита калия KJ, что приводит к восстановлению ионов Сu2+ до Сu+ и вызывает образование осадка коричневого цвета, представляющего особую смесь белого иодита меди (I) и свободного иода:
2 Сu2+ + 4J– = 2CuJ↓ + J2
Еще одна окислительно-восстановительная реакция происходит при помещении в образовавшийся раствор пять капель 1М раствора тиосульфата натрия Na2S2O3 . Тиосульфат натрия связывает свободный йод, в результате цвет осадка становится белым – это оставшийся CuJ :
2S2O32– + J2 = S4O62– + 2J–
При добавлении двадцати капель 3М раствора аммиака NH4 осадок растворяется вследствие образования бесцветного комплексного соединения меди:
CuJ + 2NH3 = Cu(NH3) 2+ + J–
Добавление одной капли 3% раствора перекиси водорода вновь окисляется Сu+ и Сu2+ , что приводит к окрашиванию раствора в глубокий синий цвет из- за образования окрашенного комплексного иона Cu(NH3) 42+
2Cu(NH3) 2+ + H2O2 + 4NH3 = 2Cu(NH3) 42+ + 2OH–
Добавляем четыре капли 0,5М раствора сульфида натрия Na2S, что приводит к разрушению комплекса вследствие образования черного осадка сульфида меди (II) CuS с очень низким произведением растворимости:
Cu(NH3) 42+ + S2– = CuS↓ + 4NH3↑
Рекомендованные концентрации и количество реагентов подобраны экспериментально, но могут потребовать корректировки из-за разных условий хранения и чистоты реактивов.
В зависимости от подготовленности учащихся и цели, которые ставит учитель, обсуждение результатов эксперимента можно проводить дифференцированно в широком диапазоне [19]. Например, на начальной стадии изучения химии серия превращения послужит эффективной демонстрации признаков химических реакций. Резкие и многократные изменения окраски раствора при добавлении всего нескольких капель реагентов всегда вызывают у школьников неподдельный интерес. В старших профильных классах результаты эксперимента могут стать поводом для обсуждения физико-химических явлений. Например, природы окраски раствора, когда один и тот же ион придает соединениям различную окраску по мере изменения связанных с ними анионов [19].
Методике определения общей жесткости воды посвящается статья [20]. Где определяют общую жесткость воды в лабораторных условиях методом комплексонометрического титрования или с помощью кальциево-магниевых ионоселективных электродов. Но эти методы требуют дорогостоящих и практически недоступных для школы реактивов и приборов, поэтому авторы [20] предлагают более приемлемый для школьной лаборатории способ с применением соляной кислоты и ортофосфата натрия. Метод основан на осаждении ионов Ca2+ и Mg2+ избытком раствора ортофосфата натрия Na3PO4 , с последующим определением остатка осадителя:
3MeCl2 + 2Na3PO4 = Me3(PO4)2↓ + 6NaCl
3Me(HCO3)2 + 2Na3PO4 = Me3(PO4)2↓ + 6NaHCO3
Как видно из приведенных уравнений, из Me(HCO3)2 образуется эквивалентное количество NaHCO3 . При титровании осадка фосфата натрия соляной кислотой одновременно оттитровывается и гидрокарбонат натрия, на определение которого расходуется такое же количество соляной кислоты, как и на определение временной жесткости воды.
Приводится методика проведения анализа: в мерную колбу, вместимостью 250 мл, переносят 100 мл анализируемой воды, добавляют точно измеренный объем (например 25 мл) 0,2М раствора Na3PO4 и оставляют на ~ 30 минут. Затем добавляют до метки дистиллированной водой, тщательно перемешивают и фильтруют через плотный бумажный фильтр в сухую емкость. В коническую колбу объемом 250 мл отбирают 100 мл фильтрата для проведения титрования и добавляют две – три капли индикатора метилоранжа, затем титруют соляной кислотой до появления бледно-розовой окраски раствора. Параллельно определяют объем соляной кислоты, пошедшей на определение временной жесткости воды в идентичных условиях. Для этого берут мерную колбу вместимостью 250 мл, добавляют 100 мл анализируемой воды, добавляют до метки дистиллированной водой и тщательно перемешивают. После этого, в коническую колбу для титрования отбирают 100 мл раствора, добавляют 2-3 капли метилоранжа и титруют соляной кислотой до появления бледно-розовой окраски. Следует однако отметить, что в школьных условиях использование данной методики так же достаточно сложно.
Авторами [21] разработана методика проведения урока по изучению химических свойств воды для школьников 8–х классов, обучающихся по единой государственной программе. Специфичность урока заключается в применении игровых моментов и метода моделирования, значительно активизирующих познавательную деятельность школьников и позволяющих достичь поставленных целей урока: добиться усвоения учащимися химических свойств воды и продолжить формирование у них умения записывать уравнения химических реакций. Перед проведением урока [21] готовится набор карточек с формулами веществ, набор схем для магнитной доски, оборудование для проведения опытов взаимодействия воды с активными металлами, оксидами, разложение воды и для решения экспериментальных задач. После проведения фронтального опроса и решения экспериментальной задачи предлагается тема урока и формируются цели. Урок проводится по следующему плану:
1. Взаимодействие воды с металлами и неметаллами.
2. Взаимодействие воды с оксидами Ме и неМе.
3. Разложение воды.
Химизм предлагаемого эксперимента подтверждается на магнитной доске по следующей схеме:
|
|




![]() Ме H2O → щелочь H2↑
Ме H2O → щелочь H2↑
актив.
Об отношении воды к металлам средней и малой химической активности, учащиеся узнают из сообщения учителя или из учебника. Работа проводится аналогичным образом: сначала моделируют общие схемы, затем учащиеся работают с набором карточек. Постепенно повышается уровень их самостоятельности в записи уравнений химических реакций.
|
|




![]() Ме H2O →
оксид H2↑
Ме H2O →
оксид H2↑
ср. актив Ме
|


![]() Ме H2O
→
Ме H2O
→
малоактив
В связи с тем, что при взаимодействии не Ме с водой не имеет общих закономерносей, то схема предлагается следующим образом:
|



не ![]() Ме H2O
→ . . . .
Ме H2O
→ . . . .
В качестве конкретизирующих уравнений химических реакций приводится взаимодействие водяного пара с углем, реакция воды с хлором. Второй пункт плана раскрывается с помощью демонстрационного эксперимента по взаимодействию оксидов фосфора (V), серы (IV), углерода (IV) и кальция с водой. Характер полученных продуктов доказывается с помощью индикаторов. Учащиеся должны выявить признаки реакции, определить их тип, назвать полученные вещества. Изучение разложения воды авторы [21] строят по-разному: с применением как исследовательского, так и иллюстративного метода. В любом случае они предлагают использовать химический эксперимент по разложению воды электрическим током. Обобщение и закрепление знаний они организуют в виде фронтальной работы с использованием фронтальной доски. На следующем уроке в ходе опроса используется дифференцированный подход.
Как отмечают авторы [22], в последнее время все очевиднее становится проблема сокращения часов, предназначенных для изучения химии, которая, в свою очередь, неизбежно скажется на школьном эксперименте. Постепенно он просто-напросто сводится на нет. Естественно, это вызывает большое беспокойство, стремление как-то преодолеть сложившуюся ситуацию. По их мнению [22], одним из способов выхода из кризиса может служить разработка и совершенствование в методическом отношении домашнего химического эксперимента как вида самостоятельной работы учащихся.
В статье [22] предлагается серия домашних опытов по теме «Вода. Растворы, Основания», способствующие развитию интереса к предмету и осознанному усваиванию основ научных знаний. Рассмотрим некоторые из предлагаемых опытов.
Опыт 1. Перегонка воды.
Оборудование и реактивы: чайник, кружка, тарелка, нагревательный прибор (электрическая или газовая плита), прихватка; вода.
Ход работы: Нагрейте в чайнике воду. Когда вода закипит и из чайника начнет выходить пар, возьмите с помощью прихватки тарелку и подержите ее несколько минут над отверстием носика чайника.
Под тарелкой расположите кружку и собирайте в нее дистиллированную воду. Сравните на вкус водопроводную и дистиллированную воду.
Объясните явление. Возьмите сухое предметное стекло, согрейте его в руках и сразу подышите на него. Дайте стеклу охладиться и снова подышите на него. Что происходит?
Вопросы для обсуждения.
1. Почему выдыхаемый воздух «заметен» на морозном воздухе и «невидим» в теплом помещении?
5. Почему в теплое время года рано утром над рекой (прудом, озером) появляется густой туман?
6. Почему в конце весны в хорошую погоду (без осадков) роса с растений утром исчезает, а к вечеру снова появляется?
Опыт 2. Обнаружение щелочных свойств растворов, применяемых в быту.
Оборудование и реактивы: 2 – 3 флакона; индикаторы (лакмус и самодельный), растворы мыла, стиральной соды Na2CO3 , питьевой соды NaHCO3 , поваренной соли NaCl , аммиака в воде NH3 × H2O , вода.
Изготовление самодельного индикатора. Пропитайте полоски фильтровальной бумаги размером 10х2 см соком черной смородины или отваром красной свеклы. Высушите их в тени и положите в темные склянки (не забудьте приклеить этикетки с названием индикатора!).
Приготовленные индикаторы, окрашиваются в кислой среде в красный цвет, а в щелочной – в зеленый или синий.
Ход работы. Исследуемый раствор в каждом сосуде разделите на две части и испытайте одну часть лакмусом, а другую – самодельным индикатором. Какие произошли изменения? Почему? Результаты запишите в таблицу.
Внимание! После каждого анализа необходимо тщательно мыть посуду, иначе результаты следующего опыта могут быть искаженными.
Вопрос для обсуждения.
Мама готовила пирог с вареньем из черной смородины. С начала варенье было красным (как обычно), а затем при добавлении взбитых белков варенье стало сине-зеленого цвета. Почему?
Опыт 3. Изучение растворимости воздуха в воде.
Оборудование и реактивы: три стеклянных пузырька (например, из под глицерина, похожие на пробирки), резиновая пробка с отверстием, прямая трубочка (стержень от шариковой ручки или соломинка для коктейля), использованный одноразовый шприц, прищепка, банка на 0,5 л; горячая вода, кипяченая
охлажденная вода.
Объясните явление. Банку заполните холодной не кипяченой водой и поставьте на стол. Наблюдайте, что происходит. Свяжите это явление с изменением температуры воды.
Ход работы. В первую импровизированную пробирку налейте кипяченую воду, во вторую и третью – холодную не кипяченую. Третью пробирку закройте пробкой с укрепленным в ней стержнем, в свободный конец которого плотно вставьте шприц, наполненный воздухом. Сделайте так, чтобы часть воздуха из него прошла в верхнюю часть пробирки. Не вынимая шприц, укрепите на стержне прищепку. Все пробирки поместите в банку с горячей водой и следите за происходящими изменениями. Почему не выделяются пузырьки газа в первой пробирке? Сравните результаты опыта во второй и третьей пробирках.
Вопрос для обсуждения.
Почему, когда вынимают пробку из бутылки с газированной водой, с шипением выделяется газ?
Опыт 4. Выращивание кристаллов.
Оборудование и реактивы: чистые банки (стаканы), картон, карандаш, нитки; вода, поваренная соль NaCl, медный купорос CuSO4 × 5H2O , калийная KNO3 и натриевая NaNO3 селитры (можно приобрести в хозяйственном магазине) или любые квасцы.
Внимание! Посуда для опытов должна быть очень чистой!
Ход работы. Сначала приготовьте насыщенный раствор выбранной вами, соли. В банку с горячей, но не кипящей водой насыпайте порциями соль и размешивайте до полного растворения. Как только соль перестанет растворяться, это значит, что при данной температуре раствор насыщен.
Полученный раствор лучше фильтровать, так как там могут находиться примеси, которые будут мешать нормальному протеканию процесса кристаллизации. Воронку перед фильтрованием ополосните кипятком!
Часть раствора слейте в другую банку. Сверху положите карандаш, вокруг которого обмотана нитка. К свободному концу нитки прикрепите затравку -– какой-нибудь маленький груз (пуговичку) так, чтобы нить распрямилась и висела в растворе вертикально, немного не доставая до дна. Через два три дня груз должен обрасти кристалликами.
П р и м е ч а н и е. Затравку можно приготовить другим способом. Банку с насыщенным раствором закройте картоном и оставьте на некоторое время. При медленном охлаждении на дно выпадут кристаллы. Слейте раствор и извлеките из банки кристаллы, обсушите их на салфетке.
Из выращенных кристаллов выберите самый привлекательный, укрепите его на нитке, привяжите его к карандашу и опустите во вновь приготовленный насыщенный раствор соли. Стакан прикройте картоном и оставьте на несколько дней (недель). Возможно, на кристаллах появятся некрасивые наросты. Их можно удалить поскоблив лезвием. Кристаллы могут расти 2 – 3 недели, а могут и полгода. Наберитесь терпения!
Выращенные кристаллы хранят в сосудах с плотно закрывающимися пробками!
Вопрос для обсуждения.
Как можно объяснить рост кристаллов?
Как отмечают авторы [22], домашние опыты и наблюдения способны изменить отношение учащихся к химии. Школьники осознают, что изучать эту науку можно не только в лаборатории, но и дома. И нет лучшего способа прийти в экспериментальную науку, как непосредственно самостоятельно экспериментируя. Подтверждение этому можно найти и в истории химии. Многие прославленные российские ученые – А.М. Бутлеров, Н.С. Курнаков, Н.Н. Семенов – истоком своего интереса к химии считали именно домашние эксперименты [22].
Изучению индивидуально-дифференцированного подхода по теме растворы рассматривается авторами [23]. Показано, что эффективная организация образовательного процесса в современной школе, не возможна без использования индивидуально-дефференцированного подхода к учащимся. Ведь основная цель школы – создать условия для самореализации личности, удовлетворения образовательных потребностей каждого ученика в соответствии с его наклонностями, интересами и возможностями, подготовить его к творческому, интеллектуальному труду. А для этого надо предоставить учащемуся право выбирать уровень обучения по каждому предмету. В обучении химии дифференциация имеет особое значение. Это обусловлено спецификой учебного предмета: у одних учащихся усвоение химии сопряжено со значительными трудностями, а у других проявляются явно выраженные способности к изучению этого предмета.
В данной ситуации учителю важно учитывать: как познавательные интересы учащихся, так и индивидуальный тип их развития. В 80-е годы Ю.К. Бабанский выдвинул идею о дифференцированной помощи учащимся, т.е. о применении таких приемов и методов обучения, которые индивидуальными путями вели бы всех школьников к одинаковому уровню овладения программой [23].
В настоящее время проблема дифференциация обучения интенсивно изучается: уточняются ее цели, формы и направления, содержание и методические пути обеспечения. Все большее признание и распространение получает концепция профильной дифференциации обучения, предусматривающая выделение трех уровней содержания учебных предметов: общекультурного, прикладного и профессионального (творческого) /В.Г. Болтянский, Г.Д. Глейзер/.
Разработка этой концепции – задача государственных органов образования, ее решение не входит в компетенцию учителя. Учитель, как правило, осуществляет дифференциацию, предлагая учащимся задания, отличающиеся объемом заложенного в них материала.
Учащиеся получают право и возможность выбирать уровень обучения, учитывая свои способности, интересы, потребности, варьировать свою учебную нагрузку, учиться адекватно оценивать свои знания. Возникает вопрос: сколько уровней овладения материалом и соответственно, дифференциации заданий, целесообразно выделить? Руководитель московского центра «Образование для всех» В.В.Фирсов предлагает ввести два уровня (обязательный и для интересующихся предметом), академик РАО В.Д. Шадриков – шесть уровней сложностей. Автору статьи [23] представляется более обоснованным мнение В.В. Гузеева, сторонника трех уровневой дифференциации знаний, что на наш взгляд более целесообразно.
Первый уровень можно назвать минимальным. Выполнение учащимися заданий этого уровня отвечает минимальным установкам образовательного стандарта. Если учащиеся ориентируются в учебном материале по случайным признакам (узнавание, припоминание), выбирают задания репродуктивного характера, решают шаблонные многократно разработанные ранее задачи, то за выполнение таких заданий они получают отметку «3».
Если учащиеся могут воспользоваться способом получения тех или иных фактов ориентируясь на локальные признаки, присущие группам сходных объектов, и проводя соответствующий анализ этих фактов, решают задачи, которые можно расчленить на подзадачи с явно выраженным типом связи, они получают отметку «4».
Проведенное анкетирование учащихся общеобразовательных школ показало, что 80 – 85% из них желают учиться на «4», поэтому такой уровень овладения материалом и, соответственно, уровень заданий называют общим. В любом классе есть ученики, которые интересуясь предметом знают больше остальных. Они могут находить свой способ решения тех или иных задач, причем даже таких, в которых кроме явной, присутствует и скрытая (латентная) связь, ориентируются на глобальные признаки, отличающие широкие классы объектов и явлений. Выполнение заданий такого уровня, называемого продвинутым, оценивается отметкой «5». Согласно закону «Об образовании» все учащиеся имеют право выбирать уровень обучения по каждому предмету.
В статье [23] приведены примеры разноуровневых заданий, составленных учителями Малоярославецкого района Калужской области, О.Л. Бобылевой, А.И. Астаховой для учащихся 8-го класса по теме « Растворение. Растворы. Свойства растворов». В качестве примера дифференцированного подхода в обучении, рассматриваются следующие уравневые задачи:
Минимальный уровень.
1. Запишите уравнения диссоциации следующих электролитов:
- карбоната натрия
- нитрата железа (III)
- гидроксида бария
- азотной кислоты.
2. Напишите уравнения практически осуществимых реакций в молекулярном и ионном виде:
Zn + HCl ®
Cu(OH)2 + HNO3 ®
CuSO4 + KOH ®
Общий уровень.
1. Какие из перечисленных веществ будут диссоциировать в воде:
- гидроксид калия
- гидроксид алюминия
- нитрат бария
- углерод
- серная кислота.
Запишите уравнение диссоциации.
2. Какие вещества реагируют между собой:
- сульфат меди (II) и гидроксид калия
- цинк и раствор серной кислоты
- карбонат кальция и соляная кислота
- сульфат натрия и соляная кислота.
Напишите уравнения практически осуществимых реакций в молекулярном и ионном видах.
Продвинутый уровень.
1. Какие электролиты надо растворять в воде, чтобы одновременно в растворе находились ионы: H+, Na+ , Cl–, SO42–, Al3+, NO3– ?
Составьте формулы и уравнения диссоциации.
2. Приведите примеры химических реакций, подтверждающих три случая протекания обмена до конца. Напишите их уравнения в молекулярном и ионном видах [23].
При изучении темы «Растворы» планируется решение расчетных задач. Так, авторы статьи [24] предлагают рассмотреть расчетные задачи на растворы, требующие глубокого понимания этого вопроса. Практика показывает, что наиболее успешно учащиеся справляются с задачами по растворам в том случае, если им были предложены простые графологические схемы и легко запоминающиеся алгоритмы решения, приводящие к составлению алгебраических уравнений. Использование алгоритмов представляет собой формальный путь решения задачи, лишающий учащихся возможности в полной мере проявить свои творческие способности.
В основу решения авторы [24] предлагают положить закон сохранения массы вещества, в соответствии с которым сумма масс растворенного вещества в смешиваемых растворах равна массе растворенного вещества в новом растворе. Массу растворенного вещества рассчитываем следующим образом:
m=m(p – pa) × w , где w - массовая доля растворенного вещества в
растворе.
А, в случае смешивания двух растворов, массу растворенного вещества можно выразить с помощью уравнения:
m1 × w1 + m2 × w2 = (m1 + m2) × w , где m1 + m2 - масса нового раствора.
Графологическая схема, отражающая это соотношение, служит основой предлагаемого алгоритма решения:
![]()
![]()
![]()
![]()
![]()
![]() w1
w2 w
w1
w2 w
|
|
|
Рассмотрим примеры:
Задача 1.
Какую массу 5% -ного раствора щелочи надо добавить к 200 г 40% -ного раствора, чтобы получить 25% -ный раствор?
1. Запишем кратко условие задачи.
Дано:
![]()
w1% = 5%; w1 = 0,05
w2 % = 40%; w2 = 0,4
w % = 25%; w = 0,25
m2 = 200 г
![]()
m1 - ?
2. Составим схему смешивания растворов:
![]()
![]()
![]()
![]()
![]()
![]() 0,05
0,4 0,25
0,05
0,4 0,25
|
|
|
3. Умножим массу каждого раствора, изображаемого на схеме, на соответствующую массовую долю, составим уравнение и решим его.
Х × 0,05 + 200 × 0,4 = (Х + 200) × 0,25
0,05 Х + 80 = 0,25 Х + 50
0,2 Х = 30
Х = 150
Ответ: Надо добавить 150 г 5% -ного раствора щелочи.
Задача 2.
Из 400 г 20% раствора при охлаждении выделилось 50 г растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
Учащимся объясняют, что в задачах такого типа чистое безводное вещество условно считать раствором с массовой долей 1 (w% = 100%), для воды соответственно имеет w =0, после этого учащиеся решают задачу с помощью алгоритма.
1. Дано:
![]()
w1% = 20%; w1 = 0,2
w2 % = 100%; w2 = 1
m1 = 400 г
m2 = 50 г
![]()
w - ?
2.
![]()
![]()
![]()
![]()
![]()
![]() 0,2
1 Х
0,2
1 Х
|
|
|
3. 400 × 0,2 – 50 × 1 = 350 Х
Х = 0,086
Ответ: Массовая доля вещества в оставшемся растворе составляет 0,086
или 8,6%
Задача 3.
В какой массе воды нужно растворить 125 г медного купороса, чтобы получить 8% - ный раствор сульфата меди?
1. Дано:
![]() М(CuSO4
× 5H2O) = 250 г/моль
М(CuSO4
× 5H2O) = 250 г/моль
m = 125 г
w% = 8%; w = 0,08
М(CuSO4) = 160 г/моль
![]()
m(H2O) - ?
2. Рассчитаем массовую долю CuSO4 в медном купоросе.
160 г/моль
w1 = ¾¾¾¾¾¾¾
250 г/моль
3.
![]()
![]()
![]()
![]()
![]()
![]() 0,64
0 0,08
0,64
0 0,08
|
|
|
4. 125 × 0,64 = (125 + Х) × 0,08
Х = 875
Ответ: Потребуется 875 г воды.
Одним из вопросов изучаемых теорией растворов являются коллоидные системы. Небольшой раздел этой темы включается в курс химии 11-го класса [25]. Дается классификация дисперсных систем, раскрывается их значение в практике, приводится характеристика дисперсных систем по внешнему виду, способности осаждаться, задерживаться фильтрами. Авторы приводят достаточно детальную характеристику коллоидных растворов, вводится понятие коагуляции, десорбция заряженных ионов. Приводятся примеры коллоидных растворов и их роль в повседневной жизни.
Более подробно коллоидные растворы характеризуются авторами [26] . Отличительной особенностью коллоидов является их многофазность, которую легко обнаружить с помощью ультрамикроскопа или при пропускании из них пучков света через раствор. Многократное отражение падающего света от частиц коллоидных размеров делает их «видимыми» невооруженным глазом (эффект Тиндаля). Итак, коллоиды – механическая смесь нескольких фаз, но очень необычная, отличающаяся от типичных механических смесей огромной поверхностью раздела фаз.
Создание монодисперсного коллоида – дело не простое, но крайне важное когда речь идет о материалах со структурно-чувствительными свойствами. Например, в высокоинтенсивных источниках света сейчас используют вольфрамовые катоды, которые являются композицией вольфрама и оксида тория (IV). В них очень мелкие частички вольфрама разделены тончайшими оксидными прослойками. Композиция работает как катод тем лучше, чем однороднее распределение компонентов [25].
Самый распространенный и наиболее изученный тип коллоидных растворов составляют системы твердое в жидком. К ним относятся истинные коллоиды – суспензии (зубная паста, лекарства, концентрированная суспензия алюмосиликатов, используемая в производстве фарфора).
Авторами [25] рассматривается свойство коллоидов. Отмечено, что коллоиды, это неопределенные вещества, а вполне определенное состояние, в котором может находиться большинство веществ.
Одной из важнейших коллоидных систем являются аэрозоли – системы, в которых жидкие или твердые частицы дисперсной фазы свободно перемещаются в газообразной дисперсионной среде. Для разрушения аэрозолей в промышленности используются электрофильтры. Между электродом и стенкой создается высокое напряжение – в несколько тысяч вольт. При электрическом разряде газа возникает большое число ионов, которые абсорбируются на частицах аэрозоля. Последние движутся под влиянием электрического поля к электродам, где коагулируют, а затем осаждаются на дне фильтра.
Наука о коллоидах, созданная в последние десятилетия, позволяет решать многие научно-технические и экологические проблемы, начиная от создания материалов с небольшим сочетанием свойств и кончая предотвращением взрывов в каменноугольных шахтах. Таким образом, растворы многообразны и играют большую роль в жизни и деятельности человека. Правильное отношение к веществам, растворам, их использованию и экологии необходимо воспитывать со школьной скамьи.
Глава 3. Реакции взаимодействия металлов с растворами солей.
Эксперимент по коллоидным растворам.
Большую роль в формировании знаний учащихся о веществе играет так же понятие о растворах.
В современном школьном курсе химии изучение растворов на начальном этапе обучения производится с целью ознакомления учащихся со средой, в которой протекают многочисленные химические реакции. Затем с растворами школьники встречаются при изучении вопросов электролитической диссоциации (растворы – электролиты), элементов главной подгруппы IV группы (коллоидные растворы). Обобщение знаний о растворах проводят в курсе химии 11-го класса.
Если говорить о классификации растворов, то можно выделить:
1. По гемогенности – это однородные системы.
2. По числу компонентов. Двухкомпонентные системы состоят из растворителя и растворенного вещества.
3. По агрегатному состоянию различают: газообразные, жидкие и твердые растворы.
Теория растворов достаточно хорошо изложена в научной и методической литературе. В первой главе мы коснулись вопроса создания проблемных ситуаций при изучении реакций в растворах на примере реакций металлов с солями и гидролиза. Тема «Гидролиз» раскрыта полностью. Реакциям металлов с солями и эксперименту по коллоидным системам повещена данная глава.
Часть 1. Реакция металлов с растворами солей.
Школьникам была поставлена задача:
В раствор сульфата меди внесите небольшой кусочек металлического лития и объясните причину образования осадка черного цвета.
Решение можно выразить следующей схемой:
Схема 1.
Решение проблемного эксперимента.
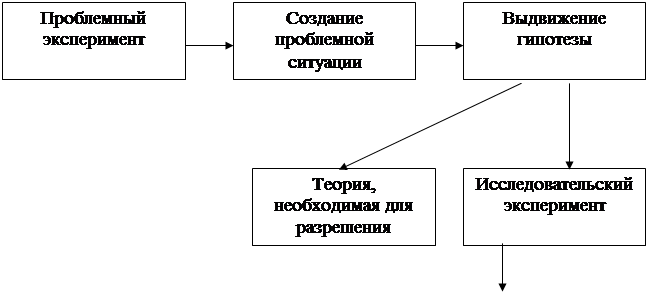
|
|
В общем изучаемый процесс вместе со школьниками изображаем условно:
CuSO4 + Li ® CuO¯ + H2
исходные вещества наблюдаемые экспериментально продукты
Вспоминаем, какие химические свойства металлов характеризует ряд стандартных электродных потенциалов:
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл, имеющий более отрицательный потенциал, способен вытеснять (восстанавливать) из раствора солей те металлы, которые имеют более положительный потенциал.
Вспоминаем, что исключение составляют лишь щелочные и щелочноземельные металлы, которые не восстанавливают ионы других металлов из растворов их солей, что связано с тем, что скорость их взаимодействия с водой, т.е. гидратация значительно превышает скорость вытеснения иона металла.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т.е. находящиеся в ряду напряжения металлов левее водорода, способны вытеснять его из растворов кислот. К этому добавляем, что самые активные металлы вытесняют водород и из воды.
Таким образом, в систему введены - сульфат меди, вода и литий. Исследуем какие возможны процессы:
- литий реагирует с водой, при этом выделяется водород, что согласуется с наблюдаемыми признаками реакции:
2Li + 2H2O ® 2LiOH + H2
Образовавшийся гидроксид лития, должен реагировать с сульфатом меди с образованием осадка гидроксида меди голубого цвета:
CuSO4 + 2LiOH ® Cu(OH)2¯ + Li2SO4
Образование осадка черного, а не голубого, цвета вызвало удивление у школьников. Проделываем опыт по взаимодействию лития не с солью, а с водой и измеряем выделившуюся при этом температуру (70°С):
2Li + 2H2O ® 2LiOH + H2 + Q
Выдвигаем гипотезу, что выделившейся при реакции гидратации лития теплоты, достаточно для разложения образовавшегося гидроксида меди:
t°
Cu(OH)2 ® CuO + H2O ( t° разложения 50°С)
осадок осадок
голубого черного
цвета цвета
Часть 2. Эксперимент по коллоидным системам.
Прежде всего, на наш взгляд, крайне интересным является вопрос о начале коллоидной науки.
Поздним осенним вечером [27] в лаборатории Британского монетного двора работали два человека. Один из них заведующий лабораторией Томас Грэм, а другой – директор монетного двора Вильям Робертс.
Меня интересует один серьезный вопрос – заговорил Грэм, это непонятные свойства кремниевой кислоты – иногда она не выпадает в осадок и остается в растворе. Я хочу заняться их изучением.
Грэм подошел к большому шкафу, достал несколько склянок и поднес их к свече. Растворы были прозрачными. Он наклонил одну из склянок, чтобы удостовериться, что на дне нет осадка. Однако раствор был неподвижен, он превратился в прозрачную желеобразную массу.
- И это раствор кремниевой кислоты? – произнес удивленный Робертс.
- Да! Посмотрите, какое желе получилось! Как будто я сварил крахмал и оставил его остывать. Постойте-постойте! Крахмал… по гречески крахмал называется «колла», т.е. клей. Не следует ли назвать этот раствор коллоидным? Это будет указывать на то, что они похожи на раствор крахмала.
Именно в тот вечер Грэм пришел к убеждению, что существуют два вида растворов – истинные и коллоидные. Грэм исследовал свойства коллоидных растворов, показал, что они неустойчивы и растворенное вещество может легко выделяться в виде осадка. Этот процесс был назван коагуляцией.
Исследования Грэма показали, что коагуляция вызывается не только добавлением в раствор солей, кислот или оснований, но и повышением температуры, продолжительным перемешиванием или иногда просто длительным отстаиванием.
Итак, появилось понятие коллоидные растворы.
Не менее интересна другая история.
На одном из заседаний Лондонского химического общества в 1867 г. к Грэму подошел Джон Тиндаль и заговорил о волновавшем его вопросе [27]:
- Я с некоторых пор изучаю рассеяние света при прохождении через мутные растворы. Коллоидные растворы тоже меня заинтересовали, и я буду просить у вас каких-либо практических указаний о получении чистых коллоидных растворов.
Скоро Тиндаль имел в своем распоряжении очищенные путем диализа коллоидные растворы и начал свои опыты.
Тиндаль наполнил стеклянную ванну коричневым раствором золя гидроокиси железа. Раствор был совершенно прозрачным и не отличался по цвету от раствора дихромата калия, например. Плотным экраном Тиндаль прикрыл лампу. Только тонкий пучок лучей пробивался через небольшое отверстие в центре экрана. Профессор направил эти лучи на ванну с коллоидным раствором. Вместо ожидаемого четко ограниченного пятна на экране появился размытый, неясноочерченный светлый круг. Тиндаль был поражен. Прошло несколько минут, а он все не мог оторваться от этой красоты, как будто в ванну было погружено какое-то тело, излучающее свет. Лучи входили в раствор, образуя круг небольшого диаметра, который постепенно увеличивался к противоположной стене ванны, образуя светящийся конус.
Эта история об открытии известного в науке эффекта Тиндаля. Результаты опытов подтвердили его первоначальные наблюдения. Попадая в коллоидный раствор пучок лучей рассеивался, образуя светящийся конус.
В 1899 г. английский физик Джон Вильям Рэлэй нашел объяснение двойному цвету коллоидных растворов и вывел формулу, которая представляла собой закон рассеивания света.
Белый свет состоит из лучей разной длинны волн: от синих – с наименьшей длинной волн, до красных – с наибольшей длинной. Когда сложный световой луч встречается с маленькой коллоидной частицей, красные лучи не изменяются, а продолжают свой путь, потому, что длинна их волн на много больше размеров частицы. А для синих лучей эта же частица является непреодолимым препятствием, потому, что ее размеры больше длинны волн синих лучей. Поэтому синие лучи отражаются от коллоидных частиц. Это приводит к обогащению проходящего через раствор света красными лучами и к отражению синих лучей.
В курсе химии средней школы с коллоидными растворами школьники встречаются в 11-ом классе при обобщении знаний по теме «Растворы», но на более высоком уровне [25].
Авторы отмечают, что коллоидные растворы имеют размер от 1 до 100 нм и относятся к тонкодисперсным системам (например, раствор яичного белка в воде). Они прозрачны, отдельные частицы обнаруживаются только при помощи ультрамикроскопа, осаждаются с трудом. Задерживаются только ультрафильтрами с очень маленькими порами (пергаментная бумага, животный пузырь). Коллоидные растворы имеют большое значение. Они образуются при растворении в воде некоторых высокомолекулярных веществ (белков), а также при химических реакциях, например, при взаимодействии растворов силикатов с кислотами выделяется кремниевая кислота, образующая с водой коллоидный раствор. По прозрачности коллоидные растворы схожи с истинными растворами. Но при пропускании луча света через них наблюдается отличие: в коллоидном растворе появляются светящийся конус, так как коллоидные частицы крупнее частиц в истинных растворах и поэтому способны рассеивать проходящий свет.
Таким образом, теоретические данные совпали с экспериментальными, что делает гипотезу достоверной.
Проверку проводили следующим образом: по реакции обмена готовили гидроксид меди (II) и вносили литий:
CuSO4 + 2LiOH ® Cu(OH)2¯ + Li2SO4
и вновь подтверждали, что теплоты реакции взаимодействия лития с водой достаточно для разложения гидроксида меди (II) на оксид и воду.
Опыты по взаимодействию лития с солями железа (III), никеля, алюминия, магния показали, что в данном случае образуются только гидроксиды, т.к. выделяемой при взаимодействии лития с водой теплоты в данном случае недостаточно для разложения гидроксидов Fe(OH)3, Ni(OH)2, Mg(OH)2 .
Использование проблемного эксперимента способствует развитию мышления школьников, повышает их творческий потенциал и активность, а также отвечает принципам развивающего обучения.
Проблемный эксперимент позволяет преодолеть односторонность, формирует более точный, многогранный взгляд на изучаемое явление, способствует установлению взаимосвязи между ними с позиции теории и окислительно-восстановительных процессов. Обучение может быть усиленным тогда, когда деятельность учителя сопровождается активной и творческой деятельностью учащихся. Условие для развития творческих способностей учащихся создается только тогда, когда проблемные ситуации образуют определенную систему.
Учащиеся, получив неожиданные экспериментальные данные, включают их в систему своих представлений по данному вопросу, объясняют опыты, устанавливают новые связи с уже известными фактами и, обогащаясь новыми экспериментальными и теоретическими сведениями приходят к пониманию более глубоких и сложных закономерностей.
Следующий опыт касался взаимодействия кальция с растворами хлорида меди (II), хлорида железа (III).
В штатив поместили пробирки с растворами хлорида меди (II) и хлорида железа (III) и вносим в каждую тщательно зачищенные кусочки кальция. В первом случае наблюдаем бурное протекание реакции с образованием газа и нерастворимых веществ различной окраски. Если поджечь газ, он горит, следовательно это водород. Внешний вид нерастворимых веществ указывает, что образуется смесь различных осадков: в начале синего цвета, с течением времени окраска меняется на беловато-голубой.
Во втором случае также наблюдается выделение водорода и образование осадков: бурого и светло-желтого цвета. Данный опыт противоречит результатам полученных по взаимодействию лития с сульфатом меди. Требуется поиск для объяснения результатов эксперимента. Выдвигается гипотеза: очевидно, кальций реагируя с водой, находящейся в растворе солей, образует основание, вступающее в обменную реакцию с растворами солей и в осадок выпадают соответствующие гидроксиды:
- по первому опыту:
Ca + 2H2O ® Ca(OH)2 + H2
Ca(OH)2 + CuCl2 ® Cu(OH)2¯ + CaCl2
или:
Ca + 2H2O + CuCl2 ® Cu(OH)2¯ + H2 + CaCl2
- по второму опыту:
Ca + 2H2O ® Ca(OH)2 + H2
3Ca(OH)2 + 2FeCl3 ® 2Fe(OH)3¯ + 3CaCl2
или:
3Ca + 6H2O + 2FeCl3 ® 2Fe(OH)3¯ + 3H2 + 3CaCl2
После составления суммарных уравнений реакций обращаем внимание на то, что продуктами взаимодействия являются и малорастворимый гидроксид кальция и различные основные соли.
На вопрос почему в данном случае не образуется осадок черного цвета оксида меди (II), последовал логичный ответ, что при гидратации кальция теплоты выделяется меньше, чем при гидратации лития, а ее недостаточно для разложения Cu(OH)2 .
Данный демонстрационный эксперимент с использованием проблемного подхода, по реакции лития и кальция с солями, является убедительным и доказательным: действительно щелочные и щелочноземельные металлы не вытесняют менее активные металлы из растворов солей, а протекают более сложные процессы, в которых участвуют как молекулы воды, так и частицы соли.
Для проведения диализа коллоидных систем был избран оригинальный диализатор – природный образец (куриная скорлупа).
Для проведения эксперимента были использованы следующие системы:
Система 1: раствор белка – сульфат аммония,
Система 2: раствор белка – сульфат натрия,
Система 3: раствор белка – хлорид натрия.
Наполовину разбавленный раствор белка вносили в яичную скорлупу, приливали насыщенный раствор соли и помещали подготовленные системы (1, 2, 3) в стакан с дистиллированной водой. Через определенные промежутки времени ( 1 час, 2часа и т.д.) брали пробу из стаканов и приливали растворы BaCl2
к системам (1, 2) и AgNO3 к системе (3). Выпадали осадки сульфата бария и хлорида серебра. Эксперимент показал, что естественный продукт яичная скорлупа может быть использована для проведения диализа коллоидных систем.
Для наблюдения эффекта Тиндаля нами был сконструирован прибор, использованный в период педагогической практики в школе №7 г. Тамбова, на уроках химии в 11-ом классе (рис.2).
Использованные системы:
1. Раствор силиката натрия.
2. Раствор яичного белка.
3. Раствор 3% желатина.
4. Раствор хлорид железа (III).
Рис. 2 Прибор для демонстрации эффекта Тиндаля в коллоидных растворах.
Выводы.
1. Проведена литературная проработка по теме дипломной работы.
2. Разработана методика формирования химического языка в курсе химии средней школы.
3. Приведены примеры и методика решения задач по химическим формулам.
4. Использован проблемный метод обучения при изучении взаимодействия активных металлов с водой.
5. Разработан конспект проблемного урока по теме «Годролиз», опробированный в 9-ом классе школы №7 г. Тамбова.
6. Подобраны системы для проведения диализа с использованием естественного продукта – яичной скорлупы.
7. Изготовлен и применен на практике прибор для демонстрации эффекта Тиндаля.
Использованная литература.
1. Г.Е. Рудзитис, Ф.Г. Фельдман. Химия 8-й класс. М.: Просвещение. 1999.
с.5 -47.
2. Л.С. Гузей, В.В. Сорокин, Р.П. Суровцева. Химия 8-й класс. М. Изд. дом «Дрофа». 1999. с. 5 – 46.
3. Н.С. Ахметов. Химия. Учебник для 8-го класса общеобразовательных учреждений. М.: Просвещение. 1998. с. 5 – 46.
4. Методика преподавания химии под редакцией Н.Е. Кузнецовой. М.: Просвещение. 1984. с. 79.
5. Д.И. Менделеев. Основы химии. т. 1. Изд. одиннадцатое. М. – Л., Гостехиздат. 1932. с. 480.
6. И.Н. Семенов. Задачи по химии повышенной сложности для абитуриентов. ч. 2. Изд. Ленинградского университета. 1991. с. 3.
7. И.Н. Семенов. Задачи по химии повышенной сложности для абитуриентов. ч. 1. Изд. Ленинградского университета. 1991. с. 4.
8. Задачи по химии. Выпуск 7. Воронежская медицинская академия им. Н.Н. Бурденко. Воронеж. 1997. с. 2.
9. Сборник упражнений и задач по органической химии. Саратовский государственный медицинский университет. Саратов. 1999. с. 4.
10. Методические указания и контрольные задания по химии. Г.И. Гущина со- ставитель. Пермская государственная фармацевтическая академия. Пермь. 2000. с. 12.
11. Ф.А. Чмиленко, И.Г. Виниченко, Г.С. Чмиленко. Подготовка к эксперименту по химии с контролем на ЭВМ. «Школа – пресс». М. 1994. с. 20.
12. В.Н. Верховский, А.Д. Смирнов. Техника химического эксперимента. т.1. М.: Просвещение. 19973. с. 360.
13. К.Я. Парменов. Химический эксперимент в средней школе. М., Из-во АПН РСФСР, 1959. с. 30-50.
14. В.С. Полосин, В.Г. Прокопенко. Практикум по методике преподавания химии. М., Просвещение. 1989. с. 300.
15. В.С. Полосин. Школьный химический эксперимент по неорганической химии. М., Просвещение. 1989. с. 200-207.
16. Г.М. Чернобельская. Основы методики обучения химии. М.: Просвещение. 1987. с. 57.
17. Р.И. Малафеев. Проблемное обучение физике в средней школе. М.: Просвешение. 1980.
18. Э.Г. Золотников. «Изучение растворимости веществ в воде». Ж. Химия в школе. №6. 94. с. 72-73.
19. В.Н. Головнер. «Семь превращений в одной пробирке». Ж. Химия в школе. №3. 2000. с. 61-64.
20. Т.Х. Чен, Е.Ю. Раткевич. «Методика определения общей жесткости воды». Ж. Химия в школе. №5. 2000. с. 80-81.
21. Е.В. Турлакова, Р.В. Дудла. «Урок по изучению химических свойств воды». Ж. Химия в школе. №1. 2000. с. 34-35.
22. Т.Н. Романина, Г.А. Шипарева. «Домашние эксперименты: интересно и познавательно». Ж. Химия в школе. №5. 98. с. 38-40.
23. Т.К. Толкачева. «Уровневая дифференциация – потребность времени». Ж. Химия в школе. №8. 2000. с. 15-18.
24. И.И. Геращенко. «Решение задач на растворы». Ж. Химия в школе. №5. 94. с. 47.
25. Г.Е. Рудзитис, Ф.Г. Фельдман. Химия. 11 класс. М.: Просвещение. 1999. с. 83-84.
26. Ю.Д. Третьяков, Ю.Г. Метлин. «Основы общей химии». Москва. Просвещение. 1980. с. 92-98.
27. К. Мачалов, Д. Лазаров, И. Лилов. У химии свои законы. Из-во «Химия». 1977. с. 86.