
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология и педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по информатике программированию
Краткое содержание произведений
Реферат: Йод
Реферат: Йод
Министерство образования РФ
Управление образования культуры и молодёжной политики
Курортного района г. Санкт – Петербурга
ГОУ средняя школа №466
Реферат по химии
ИОД
Выполнил:
Ученик 9 А класса
Якимов Павел
Руководитель:
Учители химии
Овчарова Ольга Эдуардовна
Санкт – Петербург
2003
ОГЛАВЛЕНИЕ
Страница
I.Введение 3
II.Основная часть 4
– Открытие 5
– Распространение в природе 6
– Физические и химические свойства. 7
– Получение. 8
– Иод в организме. 9
– Иод и человек 11
– Болезни, связанные с недостатком иода. 12
– Иод в медицине 14
– Иод радиоактивный 15
– Применение иода 16
– А знаете ли вы что 18
III.Заключение 19
IV.Приложения 20
V.Список используемой литературы 25
I.Введение
Иод знают все. Порезав палец, мы тянемся к склянке с иодом, точнее с его спиртовым раствором. Но не все знают насколько важно содержание иода в нашем организме. Иод является очень сильным антисептическим препаратом. Однако иод служит не только для смазывания ссадин и царапин. Хотя иода в человеческом организме всего 25 мг, он играет важную роль. Большая часть «человеческого иода» находится в щитовидной железе: он входит в состав вещества, которое регулирует обмен веществ в организме. При недостатке иода задерживается физическое и умственное развитие и возникает болезнь, называющаяся эндемический зоб. Это случается в высокогорных районах, где естественное содержание иода в воздухе, воде и пище очень низкое.
II.Основная часть
Иод – химический элемент VII группы периодической системы Менделеева. Атомный номер - 53. Относительная атомная масса 126,9045±0,0001. Галоген. Из имеющихся в природе галогенов – самый тяжёлый, если, конечно, не считать радиоактивный короткоживущий астат. Практически весь природный иод состоит из атомов одного – единственного изотопа с массовым числом 127, его содержание в земной коре 4 . 10-5% по массе. Радиоактивный иод – 125 образуется в ходе естественных радиоактивных превращений. Из искусственных изотопов иода важнейшие – иод-131 и иод-133: их в основном используют в медицине.
I2 – галоген. Темно-серые кристаллы с металлическим блеском. Летуч. Плохо растворяется в воде, хорошо – в органических растворителях (с фиолетовым или коричневым окрашиванием раствора) или в воде с добавкой солей – иодидов. Слабый окислитель и восстановитель. Реагирует с концентрированными серной и азотной кислотами, металлами, неметаллами, щелочами, сероводородом. Образует соединения с другими галогенами.
Молекула элементного иода, как и прочих галогенов, состоит из двух атомов. Иод – единственный из галогенов – находится в твёрдом состоянии при нормальных условиях. Красивые тёмно – синие кристаллы иода больше всего похожи на графит. Отчётливо выраженное кристаллическое строение (приложение 3), способность проводить электрический ток – все эти «металлические» свойства характерны для чистого иода
Открытие иода
Конец XVII и начало XVIII века были отмечены в Европе непрекращающимися войнами. Требовалось много пороха и, следовательно, много селитры. Производство селитры приняло невиданные масштабы, наряду с обыкновенным растительным сырьём в дело шли и морские водоросли. В них и обнаружили новый химический элемент.
Одним из французских селитроваров был химик и промышленник Бернар Куртуа (1777–1838), он был весьма наблюдательным человеком. Считается, что именно это помогло ему в 1811 г. стать первооткрывателем нового химического элемента иода. Однажды он заметил, что медный котёл, в котором выпаривался щелок, полученный из фукуса, ламинарий и других бурых водорослей, быстро разрушается, как будто его разъедает какая – то кислота. Куртуа решил выяснить, в чём тут дело. Осадив и удалив из раствора соли натрия, он выпарил раствор, обнаружил в котле сульфид калия и чтобы разложить его, прилил к осадку концентрированной серной кислоты – и тут появился фиолетовый дым. Куртуа повторил опыт, на этот раз в реторте, и в приёмнике реторты осели блестящие чёрные пластинчатые кристаллы.
Иодид натрия из водорослей, взаимодействуя с серной кислотой, выделяет иод I2; одновременно образуется сернистый газ – диоксид серы SO2 и воду:
2NaI + 2H2SO4 = I2 + SO2+ Na2SO4 + 2H2O
При охлаждении пары иода превращались в темно-серые кристаллы с ярким блеском. Куртуа писал: «В маточном растворе щелока, полученного из водорослей, содержится довольно большое количество необычного вещества. Его легко выделить: для этого достаточно прилить серную кислоту к данному раствору и нагреть смесь в реторте... Новое вещество осаждается в приемнике в виде черного порошка, который при нагревании превращается в пары великолепного фиолетового цвета».
Название новому элементу присвоил в 1813 году французский химик Жозеф-Луи Гей-Люссак (1778–1850) за фиолетовый цвет его паров («иодос» по-гречески значит «фиолетовый»). Он же получил многие производные нового элемента – иодоводород HI, иодноватую кислоту HIO3, оксид иода(V) I2O5, хлорид иода ICl и другие. Практически одновременно элементарную природу иода доказал и английский химик Гэмфри Дэви (1778–1829).
Распространение в природе
Среднее содержание иода в земной коре 4*10-5% по массе. В мантии и магмах и в образовавшихся из них породах (гранитах, базальтах) соединения иода рассеяны; глубинные минералы иода неизвестны. История иода в земной коре тесно связана с живым веществом и биогенной миграцией. В биосфере наблюдаются процессы его концентрации, особенно морскими организмами (водорослями, губками). Известны 8 гипергенных минералов иода, образующихся в биосфере, однако они очень редки. Основным резервуаром иода для биосферы служит Мировой океан (в 1 литре в среднем содержится 5*10-5 грамм иода). Из океана соединения иода, растворенные в каплях морской воды, попадают в атмосферу и переносятся ветрами на континенты. Местности, удаленные от океана или отгороженные от морских ветров горами, обеднены иодом. Иод легко адсорбируется1 органическими веществами почв и морских илов. При уплотнении этих илов и образовании осадочных горных пород происходит десорбция, часть соединений иода переходит в подземные воды. Так образуются используемые для добычи иода иодо - бромные воды, особенно характерные для районов нефтяных месторождений (местами 1 литр этих вод содержит свыше 100 мг иода).
![]()
Адсорбция – связывание одного вещества на поверхности другого вещества, как правило, твёрдого тела.
Физические и химические свойства
Плотность иода 4,94 г/см3, tпл 113,5 °С, tкип 184,35 °С. Молекула жидкого и газообразного иода состоит из двух атомов (I2). Заметная диссоциация I2 Û 2I наблюдается выше 700 °С, а также при действии света. Уже при обычной температуре иод испаряется, образуя резко пахнущий фиолетовый пар. При слабом нагревании иод возгоняется, оседая в виде блестящих тонких пластинок; этот процесс служит для очистки иода в лабораториях и в промышленности. Иод плохо растворим в воде (0,33 г/л при 25 °С), хорошо - в сероуглероде и органических растворителях (бензоле, спирте), а также в водных растворах иодидов.
Конфигурация внешних электронов атома иода 5s2 5p5. В соответствии с этим проявляет в соединениях переменную валентность (степень окисления): -1 (в HI, KI); +1 (в HIO, KIO); +3 (в IСl3); +5 (в НIO3, КIO3); и +7 (в HIO4, KIO4). Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром. С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды (Hg + I2 = HgI2). С водородом иод реагирует только при нагревании и не полностью, образуя йодистый водород. Элементный иод - окислитель, менее сильный, чем хлор и бром. Сероводород H2S, тиосульфат натрия Na2S2O3 и другие восстановители восстанавливают его до I- (I2 + H2S = S + 2НI). Хлор и другие сильные окислители в водных растворах переводят его в IO3-. При растворении в воде иода частично реагирует с ней; в горячих водных растворах щелочей образуются иодид и иодат. Адсорбируясь на крахмале, иод окрашивает его в темно-синий цвет; это используется в иодометрии и качественном анализе для обнаружения иода. Пары иода ядовиты и раздражают слизистые оболочки. На кожу иод оказывает прижигающее и обеззараживающее действие. Пятна от иода смывают растворами соды или тиосульфата натрия.
Получение
Сырьем для промышленного получения иода в России служат нефтяные буровые воды (приложение 2); за рубежом – морские водоросли, а также маточные растворы чилийской (натриевой) селитры, содержащие до 0,4% иода в виде иодата натрия. Для извлечения иода из нефтяных вод (содержащих обычно 20 – 40 мг/л иода в виде иодидов) на них сначала действуют хлором или азотистой кислотой. Выделившийся иод либо адсорбируют активным углем, либо выдувают воздухом. На иод, адсорбированный углем, действуют едкой щелочью или сульфитом натрия. Из продуктов реакции свободный иод выделяют действием хлора или серной кислоты и окислителя, например дихромата калия. При выдувании воздухом иод поглощают смесью двуокиси серы с водяным паром и затем вытесняют иод хлором. Сырой кристаллический иод очищают возгонкой.
Иод в организме
Иод – необходимый для животных и человека микроэлемент. В почвах и растениях таёжно-лесной нечерноземной, сухостепной, пустынной и горных биогеохимических зон. Иод содержится в недостаточном количестве или не сбалансирован с некоторыми другими микроэлементами (Са, Mn, Cu); с этим связано распространение в этих зонах эндемического зоба. Среднее содержание иода в почвах около 3*10-4%, в растениях около 2*10-5%. В поверхностных питьевых водах иода мало (от 10-7 до 10-9%). В приморских областях количество иода в 1 м3 воздуха может достигать 50 мкг, в континентальных и горных – составляет 1 или даже 0,2 мкг.
Поглощение иода растениями зависит от содержания в почвах его соединений и от вида растений. Некоторые организмы (так называемые концентраторы иода, например морские водоросли – фукус, ламинария, филлофора, накапливают до 1% иода, некоторые губки – до 8,5% (в скелетном веществе спонгине). Водоросли, концентрирующие иод, используются для его промышленного получения. В животный организм иод поступает с пищей, водой, воздухом. Основной источник иода – растительные продукты и корма. Всасывание иода происходит в передних отделах тонкого кишечника. В организме человека накапливается от 20 до 50 мг иода, в том числе в мышцах около 10 – 25 мг, в щитовидной железе в норме 6 – 15 мг. С помощью радиоактивного иода (I131 и I125) показано, что в щитовидной железе иод накапливается в митохондриях эпителиальных клеток и входит в состав образующихся в них алл - и моноиодтирозинов, которые конденсируются в гормон тетраиодтиронин (тироксин). Выделяется иод из организма преимущественно через почки (до 70 – 80% ), молочные, слюнные и потовые железы, частично с жёлчью.
В различных биогеохимических провинциях содержание иода в суточном рационе колеблется (для человека от 20 до 240 мкг, для овцы от 20 до 400 мкг). Потребность животного в иода зависит от его физиологического состояния, времени года, температуры, адаптации организма к содержанию иода в среде. Суточная потребность в иоде человека и животных – около 3 мкг на 1 кг массы (возрастает при беременности, усиленном росте, охлаждении). Введение в организм иода повышает основной обмен, усиливает окислительные процессы, тонизирует мышцы.
В связи с большим или меньшим недостатком иода в пище и воде применяют иодирование поваренной соли, содержащей обычно 10 – 25 г йодистого калия на 1 тонну соли. Применение удобрений, содержащих иод, может удвоить и утроить его содержание в сельскохозяйственных культурах. Кроме иодирования соли в последние годы стали широко применять иодирование других продуктов. Иод добавляют в некоторые хлебобулочные изделия, молоко, всё большее распространение получают так называемые БАДЫ «биологически активные добавки», содержащие иод, такие как Иод – актив, Иодомарин, Цыгапан, Кламин, и некоторые другие. Одним из самых известных препаратов для восполнения содержания иода в организме считается «Иод – актив». Мы обязаны появлению этого препарата Павлу Флоренскому. Как инженер он был жёстким и расчётливым реалистом. А вот к науке у него с детства была огромная страсть. Павлу Флоренскому было 10 лет, когда он впервые прочёл книгу Фарадея. И Майкл стал его кумиров на всю жизнь. У Флоренского никогда не было сомнений, кто открыл иод конечно Фарадей! Не случайно последним открытием Флоренского, стала формула уникального иодистого препарата, способного оберегать человека от тяжелых болезней. Открытие великого русского учёного имеет планетарное значение. Ведь проблема нехватке иода волнует граждан во всём мире. Дефицитом иода страдают около 1,5 миллиардов человек. В том числе в России от недостатка иода страдает около 70% населения. Беда, точнее катастрофа, бушует на планете. Из – за постоянной нехватки иода люди порой не блещут умом, даже взрослые. Такие люди, отличаются взрывным характером, а потому часто терпят неудачи на работе и в личной жизни. Учёные Всемирной организации здравоохранения уже однозначно пришли к выводу, что коэффициент интеллекта IQ напрямую зависит от содержания иода в организме. В нашем городе применение, таких добавок очень актуально так как, в почве, и соответственно в продуктах очень маленькое содержание иода. Поэтому для сохранения здоровья и интеллектуального потенциала населения, недостаток иода нужно восполнять.
Иод и человек
Организм человека не только не нуждается в больших количествах иода, но и с удивительным постоянством сохраняет в крови постоянную концентрацию (10-5 – 10-6 %) иода, так называемое иодное зеркало крови. Из общего количества иода в организме около 25 мг, больше половины находится в щитовидной железе. Почти весь иод, содержащийся в этой железе, входит в состав различных производных тирозина – гормона щитовидной железы, и только незначительная часть его около 1%, находится в виде неорганического иода I1-.
Большие дозы элементного иода опасны: доза 2 – 3 г смертельна. В то же время в форме иодида допускается приём внутрь в больших дозах.
Если ввести в организм с пищей значительное количество неорганических солей иода, концентрация его в крови повысится в 1000 раз, но уже спустя 24 часа иодное зеркало крови придёт в норму внутреннего обмена и практически не зависит от условий эксперимента.
В медицинской практике иодорганические соединения используется для рентгенодиагностики. Достаточно тяжелые ядра атомов иода рассасывают рентгеновские лучи. При введении внутрь организма такого диагностического средства получают исключительно чёткие рентгеновские снимки отдельных участков тканей и органов.
Болезни, связанные с недостатком иода
Еще в 1854 г. Француз Шатен – превосходный химик-аналитик обнаружил, что распространенность заболевания зобом находится в прямой зависимости от содержания иода в воздухе, почве, потребляемой людьми пище. Коллеги опротестовали выводы Шатена; более того, Французская академия наук признала их вредными. Что же касается происхождения болезни, то тогда считали, что её могут вызвать 42 причины – недостаток иода в этом перечне не фигурировал.
Недостаток иода в начале приводит лишь к небольшому увеличению щитовидной железы, но, прогрессируя, эта болезнь поражает многие системы организма. В результате нарушается обмен веществ, замедляется рост. В отдельных случаях эндемический зоб может привести к глухоте, кретинизму… Эта болезнь больше всего распространена в горных районах и в местах, сильно удаленных от моря.
О широком распространении болезни можно судить даже по произведению живописи. Один из лучших портретов Рубенса «Соломенная шляпка». У красивой женщины, изображённой на портрете, заметна припухлость кожи (врач сразу сказал бы: увеличена щитовидка). Те же симптомы и у Андромеды с картины «Персей и Андромеда». Признаки иодной недостаточности видны так же у некоторых людей, изображенных на портретах и картинах Рембрандта, Дюрера, Ван – Дейка…(приложение 4)
Интересно отметить, что история лечебного применения иода уходит в глубь веков. Целебные свойства веществ, содержащих иод, были известны за 3 тыс. лет до того, как был открыт этот элемент. Китайский кодекс 1567 г. До н.э. рекомендует для лечения зоба морские водоросли.
Благодаря включению в свой рацион морской капусты жители
северо-восточной провинции Китая Мукден, несмотря на недостаток иода в этой географической зоне, не страдали эндемическим зобом. Об их здоровье в своё время позаботился император Канси. Он предписал местным жителям съедать по 5 тинь (2 кг) морской капусты в год. И вот уже почти 2 тыс. лет послушные мукденцы
неукоснительно выполняют мудрый императорский указ.
Наиболее высокое содержание иода в водорослях:
– в сухой ламинарии – 26-180 мг на 100 г продукта
– в сухой морской капусте – 200-220 мг на 100 г продукта
В морской рыбе и продуктах моря содержание иода достигает 300-3000 мкг на 100г продукта.
Также источником иода для человека являются: мясо, молоко, яйца, овощи. (приложение 1)
Иод в медицине
Антисептические свойства иода в хирургии первым использовал врач Буанэ. Как ни странно, самые простые лекарственные формы иода – водные и спиртовые растворы – очень долго не находили применения в хирургии, хотя ещё в 1865 – 1866 гг. великий русский хирург Н.И.Пирогов применял иодную настойку при лечении ран.
Препараты, содержащие иод, обладают антибактериальными и противогрибковыми свойствами, они оказывают также противовоспалительное и отвлекающее действие; их применяют наружно для обеззараживания ран, подготовки операционного поля. При приеме внутрь препараты иода оказывают влияние на обмен веществ, усиливают функцию щитовидной железы. Малые дозы иода (микроиод) тормозят функцию щитовидной железы, действуя на образование тиреотропного гормона передних долей гипофиза. Поскольку иод влияет на белковый и жировой (липидный) обмен, он нашел применение при лечении атеросклероза, так как снижает содержание холестерина в крови; повышает также фибринолитическую активность крови.
Для диагностических целей используют рентгеноконтрастные вещества, содержащие иод. При длительном применении препаратов иода и при повышенной чувствительности к ним возможно появление иодизма – насморк, крапивница, отек квинке, слезотечение, угревидная сыпь (иододерма). Препараты иода нельзя принимать при туберкулезе легких, беременности, при заболеваниях почек, хронической пиодермии, геморрагических диатезах, крапивнице.
Иод радиоактивный
Искусственно радиоактивные изотопы иода – I125, I131, I132 и другие широко используются в биологии и, особенно в медицине для определения функционального состояния щитовидной железы и лечения ряда её заболеваний. Применение радиоактивного иода в диагностике связано со способностью иода избирательно накапливаться в щитовидной железе; использование в лечебных целях основано на способности b - излучения радиоизотопов иода разрушать секреторные клетки железы. При загрязнениях окружающей среды продуктами ядерного деления радиоактивные изотопы иода быстро включаются в биологический круговорот, попадая, в конечном счете, в молоко и, следовательно, в организм человека. Особенно опасно их проникновение в организм детей, щитовидная железа которых в 10 раз меньше, чем у взрослых людей и к тому же обладает большей радиочувствительностью. С целью уменьшения отложения радиоактивных изотопов иода в щитовидной железе рекомендуется применять препараты стабильного И. (по 100 – 200 мг на прием). Радиоактивный иод быстро и полностью всасывается в желудочно-кишечном тракте и избирательно откладывается в щитовидной железе. Его поглощение зависит от функционального состояния железы. Относительно высокие концентрации радиоизотопов иода обнаруживаются также в слюнных и молочной железах и слизистой желудочно-кишечного тракта. Не поглощенный щитовидной железой радиоактивный иод почти полностью и сравнительно быстро выделяется с мочой.
Применение иода
Иод и его соединения применяют главным образом в медицине и в аналитической химии, а также в органическом синтезе и фотографии. В промышленности применение иода пока незначительно по объему, но весьма перспективно. Так, на термическом разложении иодидов основано получение высокочистых металлов.
Сравнительно недавно иод стали использовать в производстве ламп накаливания, работающих по иодо – вольфрамовому циклу. Иод соединяется с частичками вольфрама, испарившегося со спирали лампы, образует соединение WI2, которое, попав на нагретую спираль, разлагается. Вольфрам при этом вновь возвращается на спираль, а иод опять соединяется с испарившемся вольфрамом. Иод как бы заботится о сохранении вольфрамовой спирали и тем самым значительно увеличивает время работы лампы.
Так же 0,6% иода, добавленного к углеводородным маслам, во много раз снижает трение в подшипниках из нержавеющей стали и титана. Это позволяет увеличить нагрузку на трущиеся детали белее, чем в 50 раз.
Иод применяют для изготовления специального поляроидного стекла. В стекло вводят кристаллы солей иода, которые распределяются строго закономерно. Колебания светового луча не могут проходить через них во всех направлениях. Получается своеобразный фильтр, называемый поляроидом, который отводит встречный слепящий поток света. Такое стекло используют в автомобилях. Комбинируя несколько поляроидов или вращая поляроидные стёкла, можно достигнуть исключительно красочных эффектов – это явление используют в кинотехники и в театре. Так же иод применяется в фотоделе. Современный способ фотографирования был изобретён англичанином У.Толботом. В основе его способа фотографии лежит фотохимическая реакция разложения
галогенидов серебра под действием света:
Ag (Галл) + hγ = Ag + (Галл),
Где hγ – квант света.
В современном фотографическом процессе для получения негативов используется слой фотографической эмульсии – смеси мельчайших кристалликов иодистого или бромистого серебра с желатиной (белковым веществом, «животным клеем»), - нанесённый на прозрачную подложку из стекла или полимерной плёнки. Под действием света в этой эмульсии
образуется лишь ничтожное количество металлического серебра. При последующем проявлении, т.е. при обработке фоточувствительного материала водным раствором органического восстановителя, реакция восстановления ускоряется под действием первичных частиц металлического серебра, она идёт преимущественно в тех местах, куда падал свет. Затем с помощью тиосульфта натрия (Na2S2O3 * 5H2O), образующего водорастворимую комплексную соль с галогенидом серебра, фотографии удаляют невосстановленный избыток галогенида. Эта стадия называется закреплением или фиксацией изображения. Промывка, сушка – и негатив готов.
А знаете ли вы что:
– содержание иода в крови человека зависит от времени года: с сентября по январь концентрация иода в крови снижается, с февраля начинается новый подъём, а в мае – июне иодное зеркало достигает наивысшего уровня. Эти колебания имеют небольшую амплитуду, и их до сих пор остаются загадкой;
– из пищевых продуктов много иода содержат яйца, молоко, рыба; очень много иода в морской капусте, которая поступает в продаже в виде консервов, драже и других продуктов;
– первый в России иодный завод был построен в 1915 г. В Екатеринославле (ныне Днепропетровск); получали иод из золы черноморской водоросли филлофоры; за годы первой мировой войны на этом заводе было добыто 200 кг иода;
– если грозовое облако «засеять» иодистым серебром или иодистым свинцом, то вместо града в облаке образуется снежная крупа: засеянное такими солями облако проливает дождём и не вредит полям.
IV.Заключение
Химический элемент – иод, открытый в 1811г Бернаром Куртуа, в наше время нашёл широкое применение в промышленности, технике и фотоделе. Но самое главное в медицине и не только как антисептическое средство, а как микроэлемент, который очень важен для поддержания здоровья щитовидной железы. Изучение свойств иода уже привело к появлению биологически активных добавок, которые содержат микроэлемент иод. И я надеюсь, что дальнейшее изучение иода приведёт к открытию новых возможностей применения этого элемента. И я думаю, что весь изложенный мною материал поможет не только мне, но и всем остальным людям, избежать этой болезни и узнать, что же в действительности представляет иод, и для чего он нужен.
ПРИЛОЖЕНИЯ
Приложение 1
Содержание иода в различных продуктах мг.
| Продукт | мг | Продукт | мг |
| Абрикосы | 1 | Крыжовник | 1 |
| Апельсины | 2 | Лук | – |
| Баклажаны | 2 | Морковь | 5 |
| Батон | 3,6 | Огурцы | 3 |
| Виноград | 8 | Перец сладкий | 3 |
| Вишня | 2 | Персики | 2 |
| Горошек зелёный | 5 | Помидоры | 6 |
| Груши | 1 | Редис | 8 |
| Дыни | 2 | Салат | 8 |
| Земляника (садовая) | 1 | Свёкла | 7 |
| Капуста белокочанная | 3 | Сливки | 9,3 |
| Картофель | 5 | Сливы | 4 |
| Крупа манная | – | Сметана | 7,7 |
| гречневая | 3,3 | Смородина чёрная | 1 |
| рисовая | 1,4 | Соя | 8,2 |
| пшённая | 4,5 | Сыры | – |
| перловая | – | Творог | – |
| Макаронные изделия | 2,6 | Тыква | 1 |
| Масло сливочное | – | Фасоль | 12,1 |
| Молоко коровье | 16 | Фундук | 0,2 |
| Мука пшеничная | 1,5 | Хлеб ржаной | 5,6 |
| Какао порошок | – | Чеснок | 9 |
| Картофель | 5 | Шоколад молочный | 5,5 |
| Кефир | 14 | Яблоки | 2 |
Приложение 2
Один из распространенных методов получения иода – из буровой воды методом воздушной десорбции.
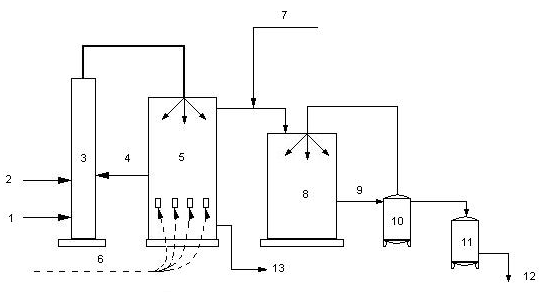
рис.1
1) буровая вода;
2) кислота;
3) башня подкисления и окисления (хлоратор);
4) хлор;
5) башня отдувки элементного иода (десорбер);
6) воздух;
7) сернистый газ;
8) уловитель (адсорбер);
9) иодоватистая и серная кислоты (сорбент);
10) сборник сорбента;
11) кристаллизатор (здесь иод выделяется из сорбента);
12) иод – сырец;
13) безиодная буровая вода;
Приложение 3
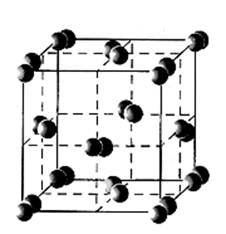
Молекулярная кристаллическая структура иода.
Приложение 4
На портретах Матисса ярко выражены признаки увеличения щитовидной железы.


Используемая литература
1. Популярная библиотека химических элементов. Изд. «Наука» Москва 1973г.
2.Химия. Энциклопедия для детей. Под редакцией Виктора Володина – «Аванта+» Москва 2000г.
3. Человек. Энциклопедия для детей. Под редакцией Виктора Володина –
«Аванта+» Москва 2002г.
4. Любознательным о химии. Б.Н.Токарев Москва издательство «Химия», 1978г.
5. Аликберова Л.Ю. Занимательная химия: Книга для учащихся, учителей и родителей. – М.: АСТ-ПРЕСС, 19994.
6. Популярная библиотека химических элементов. Изд. «Наука» Москва 1973г.
7. Степин Б.Д; Аликберова Л.Ю. Книга по химии для домашнего чтения. – 2-е изд. – М.: Химия, 1995.
8.Овощи и плода в питании. В.А.Доценко. «Лениздат» 1988г.
9. Справочник по диетологии. Под редакцией А.А.Покровского. Изд. «Медицина» Москва 1981г.
10. Витамины и витаминотерапия. В.Е.Романовский. «Феникс» Ростов - на - Дону 2000г.