Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология и педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по информатике программированию
Краткое содержание произведений
Реферат: Электросинтез хлорной кислоты
Реферат: Электросинтез хлорной кислоты
МИНИСТЕРСТВО ВЫСШЕГО ОБРАЗОВАНИЯ РФ
КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра ТЭП
РЕФЕРАТ
по ОЭХТ на тему:
“Электросинтез хлорной кислоты”
Принял: Андреев И. Н.
Выполнила студентка гр. 67-31 Кушмна Г.Ш.
Казань – 2002
Содержание
1. Первоначальное получение хлорной кислоты.
2. Области применения.
3. Свойства хлорной кислоты.
4. Производство хлорной кислоты.Реакции на электродах и условия электролиза.
5. Технологическая схема производства хлорной кислоты.
6. Конструкции электролизеров.
7. ПД – портрет ЭХО.
8. Список использованной литературы.
1. ПЕРВОНАЧАЛЬНОЕ ПОЛУЧЕНИЕ ХЛОРНОЙ КИСЛОТЫ.
Первое сообщение о синтезе хлорной кислоты содержится в статье Стадиона, который в 1816 г. получил её путем перегонки продукта, образующегося при осторожном плавлении хлората калия в смеси с концентрированной серной кислотой. Стадион внес важный вклад в исследование хлорной кислоты не только как первооткрыватель, но и как исследователь, впервые получивший её электролизом раствора двуокиси хлора.
Хлорная кислота была получена в 1835 г. Берцелиусом при электролизе соляной кислоты, а позже – при электролизе водного раствора двуокиси хлора и взаимодействием перхлората калия с серной кислотой.
В первой половине XIX в. были выделены и изучены перхлораты многих металлов. Электрохимическое производство этих солей было запатентовано Карльсоном в 1890 г.
Первое промышленное производство перхлоратов было создано в Швеции в 1893 г. по электрохимическому методу. В начале XX в. было организовано промышленное производство перхлоратов во Франции, Швейцарии, США и Германии, однако масштаб производства был невелик и мировая выработка перхлоратов до первой мировой войны не превышала 2000—3000 т/год
Во время первой мировой войны производство перхлоратов получило интенсивное развитие в связи с применением этих солей для производства взрывчатых веществ . Мировое производство перхлоратов возросло до 50 тыс. т в год. После окончания войны производство перхлоратов резко сократилось и получило новое развитие только в годы второй мировой войны.
2.ОБЛАСТИ ПРИМЕНЕНИЯ.
Области применения хлорной кислоты и ее солей довольно разнообразны. Хлорная кислота используется для получения различных перхлоратов, для разрушения органических веществ, как добавка в электролит в гальванотехнике, применяется в качестве реагента в аналитической химии, при электрополировании металлов, как катализатор в процессах гидролиза и этерификации.
Помимо перечисленных выше основных потребителей, хлорная кислота и ее соли применяются в небольших количествах в самых разнообразных отраслях народного хозяйства: они широко используются в аналитической химии (например, при количественном определении калия в виде малорастворимого перхлората калия), в фотографии в качестве сенсибилизирующих добавок, как сильные осушающие средства и для других целей. Хлорная кислота как сильный окислитель используется для окисления и разрушения органических веществ (влажное сожжение), для окисления руд; ее применяют также в качестве растворителя, среды для неводного титрования, для разрушения протеинов при биологических анализах, как добавка к электролиту в гальванотехнике и при электролитической обработке металлов.
В последние годы интенсивно развивается и техника производства перхлоратов и хлорной кислоты. Стали широко применяться новые электродные материалы и электроды, совершенствуется технология на всех стадиях процесса .В настоящее время производство хлорной кислоты и перхлоратов организовано практически только по электрохимическому методу.
3.СВОЙСТВА ХЛОРНОЙ КИСЛОТЫ.
Хлорная кислота—НСLO4—одна из наиболее сильных неорганических кислот. Безводная хлорная кислота представляет собой бесцветную подвижную жидкость плотностью 1768 кг/м3 при 20 °С, сильно дымящую во влажной атмосфере. Вязкость хлорной кислоты при 20 °С равна 0,795 10-3 Па- °С, т. е. меньше вязкости воды.
Безводная хлорная кислота плавится при температуре около —102 °С, кипит с разложением при 110°С. Теплота ее образования из элементов 36,1 кДж/моль, плавления 6,93, испарения 43,6 кДж/моль и теплота разбавления в 800 частях воды 88,5 кДж/моль.
С водой хлорная кислота образует ряд гидратов:
Тпл.,0С Тпл.,0С
HCLO4 0.25H2O |
-73.1 |
HCLO4 3H2O |
-40.2 |
HCLO4 H2O |
49.905 |
HCLO4 3.5H2O |
-45.6 |
HCLO4 2H2O |
-20.65 |
HCLO4 4H2O |
-57.8 |
HCLO4 2.5H2O |
-32.1 |
Диаграмма плавкости системы вода—хлорная кислота приведена на рис. 1
В табл. 1 приведена плотность водных растворов хлорной кислоты при различной температуре.
Водные растворы хлорной кислоты обладают хорошей электропроводимостью и используются как электролиты для проведения некоторых электрохимических процессов, в частности, для получения хлорной кислоты.
В табл. 2 приведено удельное электрическое сопротивление водных растворов хлорной кислоты при различной температуре.
Температура кипения растворов хлорной кислоты различной концентрации при давлении 2,4 кПа составляет:
|
Концентрация НСLO4, масс.% |
100 | 94,8 | 92,0 | 84,8 | 79,8 | 70,5 |
|
Температура кипения, °С |
16,0 | 24,8 | 35 | 70 | 92 | 107 |
Безводная хлорная кислота весьма реакционно-способна, при соприкосновении со многими легкоокисляющимися органическими веществами она взрывается. Безводная хлорная кислота — сильный окислитель. Элементарный фосфор и сера окисляются хлорной кислотой до фосфорной и серной кислоты. Иод окисляется хлорной кислотой; бром, хлор, а также НВг и НСL не взаимодействуют с нею даже при нагревании.
Таблица 1. Плотность водных растворов хлорной кислоты в интервале от —25 до 75 °С (в г/см3)
| Концентрация, % | Температура, °С | ||||||
| - 25 | 0 | 15 | 20 | 30 | 50 | 70 | |
| 10 | — | 1,0637 | 1,0597 | 1,0579 | 1,0539 | 1,0437 | 1,023 |
| 20 | — | 1,1356 | 1,1279 | 1,1252 | 1,2000 | 1,1075 | 1,096 |
| 30 | 1,2312 | 1,2168 | 1,2067 | 1,2033 | 1,1965 | 1,1821 | 1,160 |
| 40 | 1,3308 | 1,3111 | 1,2991 | 1,2947 | 1,2866 | 1,2703 | 1,251 |
| 50 | 1,4528 | 1,4255 | 1,4103 | 1,4049 | 1,3944 | 1,3752 | 1,350 |
| 60 | 1,5908 | 1,5580 | 1,5386 | 1,5327 | 1,5218 | 1,4994 | 1,470 |
| 70 | 1,7306 | 1,6987 | 1,6736 | — | — | 1,6344 | 1,617 |
| 80 | — | — | — | — | — | 1,7540 | 1,727 |
| 90 | — | — | — | — | — | 1,7720 | 1,738 |
| 95 | — | — | — | 1,8043 | — | 1,7515 | 1,704 |
| 100 | — | 1,8077 | — | 1,7676 | —— | 1,7098 | — |
Таблица 2. Удельное электрическое сопротивление водных растворов хлорной кислоты (в Ом-м-102)
| Температура, °С |
Концентрация НClO4 масс. % |
||||||
| 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 50 | 2,207 | 1.272 | 1,028 | 1,001 | 1,154 | 1,540 | 2,401 |
| 40 | 2,428 | 1.397 | 1.132 | 1.106 | 1.286 | 1,725 | 2,704 |
| 30 | 2.715 | 1,562 | 1,262 | 1,240 | 1,452 | 1,961 | 3,084 |
| 20 | 3,100 | 1776 | 1.436 | 1,414 | 1,670 | 2,275 | 3,575 |
| 10 | 3,628 | 2,072 | 1,665 | 1.647 | 1.964 | 2,705 | 4,227 |
| 0 | 4,420 | 2.488 | 1,992 | 1.968 | 2.376 | 3,320 | 5,129 |
| —10 | — | 3.102 | 2.464 | 2.436 | 2.982 | 4,242 | 6,418 |
| —20 | — | — | 3,176 | 3.133 | 3.919 | 5,742 | — |
| —30 | — | — | — | 4,250 | 5.505 | 8,402 | 11,59 |
| —40 | — | — | — | 6.21 | 844 | 13.82 | — |
| —50 | — | — | — | 10,41 | — | 27,10 | — |
Хлорная кислота при хранении при комнатной температуре медленно разлагается, что обнаруживается по потемнению жидкости вследствие окрашивания ее продуктами разложения. Такая кислота опасна при хранении, так как может самопроизвольно взрываться. Поэтому обычно безводную хлорную кислоту не хранят, а стараются готовить непосредственно перед ее использованием.
Стабильность хлорной кислоты может быть повышена добавками ингибиторов. В качестве ингибиторов могут служить, в частности, органические соединения, содержащие трихлорметильную группу. Наиболее эффективными ингибиторами являются трихлоруксусная кислота и тетрахлорид углерода.
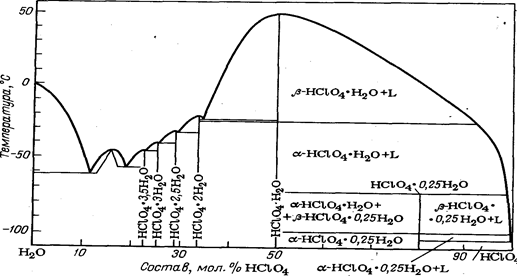
Рис. 1. Диаграмма плавкости системы НСLO4—Н2O.
Все работы, связанные с использованием хлорной кислоты и ее солей, требуют большой осторожности. При наличии примесей в хлорной кислоте возможен самопроизвольный распад кислоты со взрывом.
Попадание хлорной кислоты на кожные покровы приводит к болезненным химическим ожогам.
Хранить и перевозить хлорную кислоту разрешается только в виде водного раствора с концентрацией не более 70% НСLO4. В случае необходимости применения безводной или концентрированной хлорной кислоты, последнюю готовят непосредственно перед использованием. Срок хранения концентрированной кислоты крайне ограничен, особенно при потемнении жидкости из-за окрашивания ее продуктами разложения.
4.ПРОИЗВОДСТВО ХЛОРНОЙ КИСЛОТЫ .РЕАКЦИИ НА ЭЛЕКТРОДАХ И УСЛОВИЯ ЭЛЕКТРОЛИЗА.
При электролизе водных растворов соляной кислоты на аноде возможно выделение элементарного хлора или кислорода, а на электродах с высоким анодным потенциалом — также образование высших кислородных соединений хлора — хлорной кислоты. В зависимости от условий проведения процесса и прежде всего от концентрации ионов С1-, температуры и применяемого анодного материала, скорости этих трех процессов могут очень сильно изменяться.
При электролизе концентрированной соляной кислоты на анодах всех видов, стойких в этих условиях, происходит выделение элементарного хлора с выходом по току, близким к 100%. По мере снижения концентрации соляной кислоты выход хлора по току уменьшается за счет увеличения скорости выделения кислорода на аноде, а при применении графитовых анодов и за счет окисления графита. Образование хлорной кислоты наблюдается только в сильно разбавленных растворах НС1. При электролизе 1 н. раствора на платиновых анодах соляная кислота расходуется практически нацело на получение хлора, а образование хлорной кислоты идет в очень малой степени. При снижении концентрации соляной кислоты до 0,1 н. примерно 50% НС1 расходуется на образование хлорной кислоты и 50% — на получение газообразного хлора.
Окисление ионов хлора до хлорной кислоты протекает при высоком положительном потенциале 2,8—3,0 В. На графитовом аноде в водных растворах хлоридов невозможно достичь такого потенциала, поэтому на этих анодах образование хлорной кислоты не наблюдается даже в сильно разбавленных растворах.
УСЛОВИЯ ЭЛЕКТРОЛИЗА.
Процесс электрохимического синтеза хлорной кислоты на аноде описывается следующим суммарным уравнением:
НСL + 4Н2О – 8e - -- НСLO4 + 8H + (1)
На катоде происходит выделение водорода.
В процессе электролиза растворов хлороводородной кислоты на аноде возможно образование хлора, кислорода и хлорной кислоты. В зависимости от условий проведения электролиза, таких как концентрация ионов хлорида, температура и применяемый анодный материал, скорость образования этих трех веществ в значительной степени может изменяться. Образование хлорной кислоты наблюдается только в разбавленных растворах хлороводородной кислоты.
Для получения хлорной кислоты необходимо применять аноды, на которых можно добиться высокого перенапряжения для процессов, конкурирующих с окислением хлор-иона до иона С104- т.е. для процессов выделения хлора и кислорода. В рассматриваемом случае это достигается на платиновых или платино-титановых анодах при низкой концентрации хлор-ионов и низкой температуре электролиза. При этом, естественно, получают хлорную кислоту низкой концентрации. Из-за малой электропроводности электролита напряжение на ячейке и расход электроэнергии велики.
При электролизе 0,5 н. раствора соляной кислоты получена хлорная кислота концентрацией до 20 г/л. При невысокой плотности тока и температуре 18 °С напряжение на ячейке составляло 8 В, а расход электроэнергии около 47кВт.ч/кг 100%-ной хлорной кислоты. Недостатки такого способа заключаются в большом расходе электроэнергии и низкой концентрации получаемой хлорной кислоты.
Для снижения удельного электрического сопротивления электролита и соответственно потерь напряжения в электролите электролизу подвергают разбавленные растворы соляной кислоты в растворах сильных электролитов. Наиболее удобно вести процесс окисления иона С1- до СLO4-в растворах хлористого водорода или хлора в концентрированной 4—6 н. хлорной кислоте. При этом возможна организация непрерывной подачи хлористого водорода, соляной кислоты или хлора в электролит и отвода части электролита в виде концентрированной хлорной кислоты для окончательной переработки ее в готовую продукцию .
Протекание процесса электролиза зависит от потенциала анода, концентрации хлорной и соляной кислот в электролите, температуры электролиза и плотности тока .
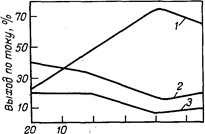
При изменении концентрации НС1 в электролите при прочих равных условиях изменяется как плотность суммарного тока, так и плотность парциальных токов, расходуемых на образование СLO4- и другие процессы, протекающие одновременно на аноде. На рис. 2 показана зависимость плотности общего и парциальных токов получения СLO4- и СL2 от концентрации соляной кислоты в электролите при проведении электролиза при температуре —20 °С. С повышением температуры электролиза резкое увеличение плотности тока выделения СL2 и снижение плотности тока образования СLO4- наступает при более низкой концентрации НС1 в электролите.
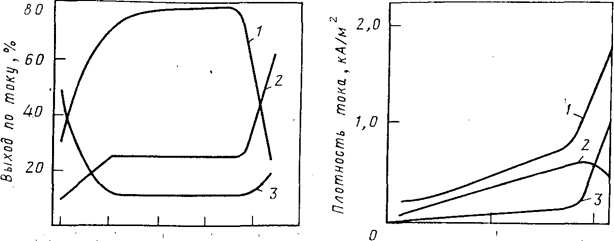
Концентрация НСL,кмоль/м3 Концентрация НСL,кмоль/м3
|
Рис.2. Зависимость выхода по току различных продуктов электролиза от концентрации хлороводородной кислоты в 4 н. растворе хлорной кислоты при температуре —20 °С: 1 — НСLO4; 2 — С12; 3 —О2 |
Рис. 3. Зависимость плотности тока, расходуемой на образование СLO4 и СL2, а также общей плотности тока от концентрации НСL в электролите (4 н. раствор НСLO4) при температуре —20°С: 1 —общий ток; 2—ток на образование СLO4-; 3—ток на выделение СL2 |
С изменением концентрации НС1 в электролите меняется соотношение парциальных токов, расходуемых на образование СLO4- и выделение СL2 и O2. На рис. 3 приведена зависимость выхода по току продуктов электролиза от концентрации соляной кислоты в электролите. Данные получены при 20 °С в 4 н. НСLO4 на платиновых анодах с потенциалом 2,8 В
Наиболее высокие значения выходов хлорной кислоты по току получены для соляной кислоты концентрацией 0,8—2 н. При снижении концентрации соляной кислоты ниже 0,8 н. выход НСLO4 по току уменьшается за счет увеличения выхода кислорода по току. При повышении концентрации НС1 более 2 н. возрастает расход тока на выделение хлора, и выход по току хлорной кислоты также резко снижается. Оптимальная концентрация соляной кислоты в электролите увеличивается при снижении температуры электролиза и зависит от концентрации хлорной кислоты в электролите.
Процесс анодного окисления соляной кислоты в хлорную сильно зависит от температуры. На рис. 4 приведена зависимость выхода по току продуктов электролиза от температуры раствора при содержании в электролите 4 н. НСLO4 и 1 н. НС1 и значении потенциала анода 2,8—3,0 В. С понижением температуры выход хлорной кислоты по току возрастает, а хлора и кислорода соответственно снижается.
Содержание примесей в хлорной кислоте зависит от чистоты исходной соляной кислоты и применения достаточно стойких к коррозии конструкционных материалов для изготовления электролизеров, трубопроводов и аппаратуры. В отбираемой из электролизера хлорной кислоте содержится значительное количество ионов хлора. Для получения товарной кислоты необходима ее очистка от ионов хлора, которую осуществляют электрохимическим способом, т.е. возможно более полным окислением ионов хлора до хлорной кислоты. Однако при этом по мере снижения концентрации ионов хлора выход хлорной кислоты по току снижается и приближается к нулю при достаточно полной очистке раствора от примесей соляной кислоты. С увеличением степени очистки хлорной кислоты от ионов хлора снижается общий выход по току, возрастают расход электрической энергии и скорость коррозии платиновых анодов.
|
Температура., °С Рис. 4. Зависимость выхода по току различных продуктов электролиза 1 н. раствора НС1 в 4 н. НСLO4 от температуры: 1— НСLO4; 2—С12; 3—O2, |
При очень высоких требованиях к чистоте хлорной кислоты последнюю можно дополнительно очищать от примесей НС1 отгонкой или отдувкой соляной кислоты инертным газом. Для очистки хлорной кислоты, получаемой из электролизеров продукционной стадии, от соляной кислоты можно применять также ректификацию. При этом отпадают трудности, связанные с электрохимической очисткой, и достигается более высокий суммарный выход хлорной кислоты по току. Хлористый водород, отгоняемый из хлорной кислоты при ректификации, можно вновь возвратить на стадию продукционного электролиза.
Хлорную кислоту можно получать также анодным окислением хлора, растворенного в электролите — в 4—6 н. растворе хлорной кислоты . При электролизе таких растворов на платиновых анодах и серебряных катодах электролизеры, рассчитанные на нагрузку 3,5 кА при плотности тока 2 кА/м2 и температуре О °С, работали при напряжении 4 В. Процесс описывается суммарным выражением
СL2 + 8Н20 — 2 НСLO4 + 7 Н2 (2)
По этому методу может быть получена очень чистая кислота, поскольку со стороны не вводятся никакие загрязняющие примеси. Часть электролита отбирают и после перегонки получают 60—70%-ную товарную кислоту.
Для электрохимического получения хлорной кислоты применяют электролизеры с платиновыми или платино-титановыми анодами . Вследствие очень высокой коррозионной активности смесей хлорной и соляной кислоты в качестве катода часто применяют графит. Графитовые катоды легко выдерживают остановки, связанные со снятием катодной поляризации. Известно, что при анодной поляризации платины в не сильно разбавленных растворах соляной кислоты при потенциалах отрицательнее 1,1—1,2 В (против н. в. э) происходит анодное растворение платины с выходом по току, близким к 100%. В этих условиях скорость растворения платины увеличивается с ростом потенциала, кислотности раствора и температуры. При потенциале платины (в анодную сторону) выше 1,1—1,2В наблюдается пассивация платины и при потенциале 1,3В в 1 н. НС1 скорость растворения платины снижается до 4•10-5A/м2
Пассивация поверхности платинового анода, наблюдаемая в процессе электрохимического получения хлорной кислоты, связана с образованием на поверхности слоев адсорбированного кислорода и фазовых оксидов различного состава. Структура оксидных слоев на поверхности платины и ее коррозионная стойкость зависят от соотношения концентраций НС104 ,и НС1 в электролите. В процессе электролиза соляной кислоты с целью получения хлора и водорода добавление к электролиту 50—150 г/л хлорной кислоты снижает скорость анодного растворения платины. При электролизе чистых растворов НС104 кислород связан с поверхностью платины более прочно, чем при электролизе смесей НС104 и НС1
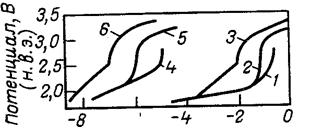
На рис. 5 приведена зависимость плотности общего тока поляризации на платиновом аноде и плотности тока растворения платины от потенциала анода при электролизе 3 н. НС104 при различных температурах .
С увеличением содержания НС1 в электролите количество фазовых оксидов на поверхности анода уменьшается. В процессе электролиза смесей НС104 и НС1 при высоких анодных потенциалах и постоянной суммарной кислотности увеличение содержания НС1 в электролите или растворение элементарного хлора приводит к повышению коррозионной стойкости платинового анода . Как при комнатной, так и при пониженной температуре, увеличение содержания НС1 в электролите или насыщение его элементарным хлором приводит к снижению плотности тока растворения платины. Результаты исследований, проведенных при температурах —15 и —25 °С и потенциале 2,8В (н.в.э.), приведены на рис. 6.
На рис. 7 приведена зависимость доли тока, расходуемого на растворение платины, от концентрации НС1 в электролите или от насыщения электролита хлором для тех же условий электролиза.
При увеличении концентрации НС1 плотность тока растворения платины и доля тока, расходуемого на ее растворение, снижаются, особенно сильно при введении первых порций НС1 в электролит. Поэтому при выборе условий электрохимического производства хлорной кислоты целесообразно применять верхний предел концентрации НС1, при котором еще не наблюдается существенного снижения выхода хлорной кислоты по току. С понижением температуры электролиза, эта наиболее целесообразная концентрация НС1 в электролите возрастает .
Насыщение электролита элементарным хлором снижает плотность тока растворения платины, но мало влияет на долю тока, расходуемого на растворение, так как практически в равной мере снижаются скорости основных анодных процессов и общая плотность поляризующего тока .
Ранее для изготовления анодов применяли платиновые проволоки или фольгу. В настоящее время используются платино-титановые аноды, в которых платина в виде тонкой фольги приваривается к титановой основе электрода При длительном электролизе происходит постепенное разрушение платино-титановых анодов, как за счет растворения платины на работающей поверхности анода, так и вследствие нарушения контакта между платиновой фольгой и титановой основой. При этом платина, перешедшая в раствор, частично осаждается на графитовых катодах; остальная ее часть выводится из электролизера с потоком хлорной кислоты. Платина осаждается в поверхностном слое графитового катода толщиной не более 100 мкм.
При включении нового электролизера со свежими графитовыми катодами содержание платины в хлорной кислоте, отбираемой из электролизера, составляет 0,3—0,5 мг/л, но по мере отложения платины на поверхности графитового катода условия осаждения ее на катоде изменяются. Скорость осаждения платины на катоде снижается. Это приводит к уменьшению осаждения платины из
|
|
lg j, A/см2
Рис. 5. Влияние потенциала на скорость суммарного анодного процесса (/—3) и скорость растворения платины 4—6 в 3 н. Н НС104 при различной температуре:
1,4—при 57 °С: 2,5—при 25 0С; 3.5 — при —180С.
|
400 800 1200 1600 2000 0 400 800 1200 1600 2000 Время, мин Время, мин |
|
Рис. 6. Скорость растворения платины в электролитах разного состава (в н.): 1—ЗНС104 ; 2—ЗНС104 +0.01НС1; 3- 2,9НС104 + 0.1НС1; 4—2НС104 + 1НС1; 5—ЗНС104 .насыщенный С12 |
Рис. 7. Доля тока, расходуемого на растворение платины в электролитах разного состава (обозначения те же, что и на рис. 6). |
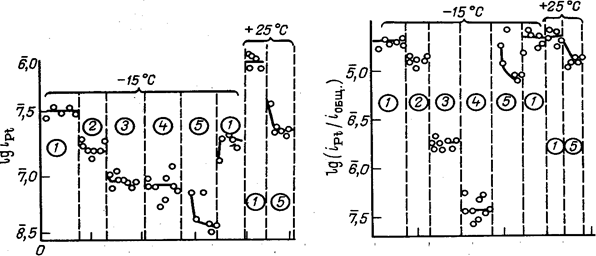
раствора на катоде к постепенному возрастанию содержания платины в растворе, вытекающем из электролизера, до 2—2,5 мг/л .Стационарная концентрация платины в электролите зависит также от его состава и несколько возрастает с увеличением концентрации НС104 в интервале от 300 до 600 г/л и концентрации НС1 в интервале от 0 до 30 г/л.
|
|
|
|
|
Рис. 7. Зависимость равновесной концентрации платины от содержания НС104 в электролите (концентрация НС1 16—18г/л, содержание Pt на графите 9,9 мг/см2, температура 24—26 °С). |
Рис. 8. Зависимость равновесной концентрации платины от содержания НС1 в каталите (концентрация НС104 423—433 г/л, содержание платины на графите 9,0 мг/см2, 24—26°С). |
На рис. 7 и 8 показано изменение количества платины в катодном пространстве, отделенном малопроточной диафрагмой от анодного пространства, через 5—7 ч электролиза при начальном содержании ее в катодной жидкости 6,8 мг/л. Повышение содержания НС1 и НС104 в электролите в исследованных пределах приводит к снижению скорости осаждения платины на графите и увеличению остаточного содержания ее в жидкости в 1,3—1,5 раза .Платина, осажденная на катоде, может быть собрана и возвращена на регенерацию; платина, уносимая из электролизера с потоком хлорной кислоты, теряется безвозвратно.
При определенных условиях процесса наиболее уязвимым в платино-титановых электродах является место приварки платиновой фольги к титановой основе электрода. В этом месте образуются сплавы платины с титаном переменного состава, которые отличаются меньшей коррозионной стойкостью, чем платина.
В качестве основы анода может быть использован также тантал. При испытаниях платино-танталовых анодов, полученных нанесением платины на танталовую основу электрода электроискровым способом, при потенциалах 3,0—3,1 В и комнатной температуре полученные электрохимические показатели аналогичны показателям на платино-титановых анодах. При температуре —20 °С выход хлорной кислоты и хлора по току несколько ниже, а кислорода выше, чем на платино-титановом аноде. Это, по-видимому, можно объяснить образованием платино-танталовых сплавов на поверхности анода при нанесении платины электроискровым способом
Для получения хлорной кислоты в качестве анода могут быть использованы и другие металлы платиновой группы. Электролиз смешанных растворов НС104 и НС1 (содержание НС1 1 н.) предложено проводить на иридиевом аноде в интервале (—5)—(—30) °С при анодном потенциале 2,9—3,3 В, а также на родиевом аноде. Однако в промышленных условиях обычно применяются пла-тино-титановые аноды.
5.ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВА.
Технологическая схема производства хлорной кислоты включает следующие основные стадии: приготовление электролита, электролиз, вакуумная дистилляция и получение безводной кислоты.
Содержание примесей в хлорной кислоте зависит от чистоты исходной хлороводородной кислоты, а также от типа конструкционных материалов электролизеров, трубопроводов и вспомогательной аппаратуры. С целью уменьшения содержания ионов хлорида в получаемой хлорной кислоте обычно используют каскад электролизеров, в котором осуществляется более полное окисление хлорид-ионов до НСLO4.
При получении хлорной кислоты путем анодного окисления хлора удается обеспечить очень высокое качество НСLO4, так как с хлором в электролит не вводится никаких примесей.
На стадии приготовления электролита часть хлорной кислоты, полученной в результате электролиза, из сборника насосом перекачивают в холодильник, в котором с помощью охлаждающего рассола понижают ее температуру до —5 "С. После охлаждения хлорную кислоту направляют в абсорбер, в который также подают хлор. В абсорбере осуществляют насыщение раствора хлорной кислоты хлором. Раствор, содержащий 40% (масс.) НСLO4 и около 3 кг/м3 растворенного хлора, с температурой О °С выводят из абсорбера и подают на электролиз. Из электролизера через промежуточный сборник выводят раствор хлорной кислоты, содержащей незначительное количество хлора и хлористого водорода, и направляют на вакуумную дистилляцию. В процессе дистилляции при давлении 2,66—3,23 кПа отгоняются пары воды, хлор и хлорид водорода. Отогнанные пары конденсируют в холодильнике и возвращают в сборник на стадию приготовления электролита.
Полученную хлорную кислоту с температурой около 90 °С направляют в холодильник и далее через вакуумный приемник в виде 60—70%-го раствора подают в сборник готового продукта.
При получении безводной хлорной кислоты используют процесс обезвоживания раствора хлорной кислоты олеумом с вакуумной отгонкой НСLO4 в обогреваемом аппарате из кварцевого песка.
6. КОНСТРУКЦИИ ЭЛЕКТРОЛИЗЕРОВ.
В литературе имеется мало публикаций о конструкциях современных электролизеров
Известно, что используются в основном монополярные ящичные электролизеры с платино-титановыми анодами и графитовыми катодами. При применении электролизеров без диафрагмы выделяющийся на катоде водород загрязняется хлором и кислородом в количествах, превышающих взрывобезопасные пределы. В этом случае газы в электролизере следует разбавлять инертными газами.
При использовании электролизеров с диафрагмой их конструкция усложняется, а напряжение на электролизере возрастает. Однако вследствие разделения анодного и катодного пространств получаемые водород и хлор достаточно чистые и могут быть использованы; облегчаются создание безопасных условий работы и защита окружающей среды от вредных газовых выбросов.
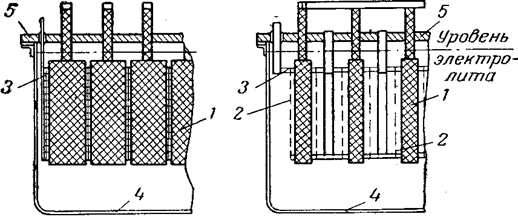
Рис. 8 Хлоратный электролизер Ангела:
1 — графитовые аноды; 2 — катоды; 3 — катодная рама;
4 — корпус электролизера; 5 — крышка.
Сообщается о применении для получения хлорной кислоты электролизеров фильтр-прессного типа с биполярным включением электродов. Рамы электролизера, изготовленные из поливинилхлорида, снабжены диафрагмой из сетки, выполненной из полимерных материалов. Аноды покрыты платиновой фольгой, катоды — серебряные. Электролизер на нагрузку 5 кА работал при плотности тока 2,5 кА/м и напряжении на ячейке 4,4 В; выход по току составил около 60%.
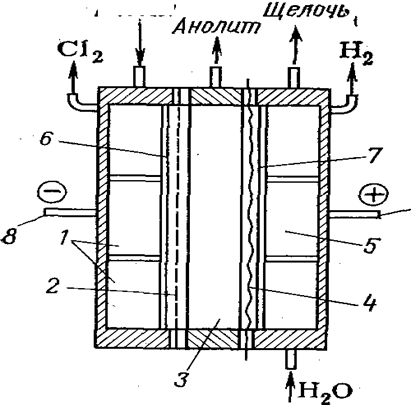
Предложено также получать хлорную кислоту анодным окислением водных растворов хлоратов в трехкамерном электролизере (рис. 9)с двумя ионообменными мембранами. При применении платиновых или платино-титановых анодов в анодном пространстве можно получить достаточно чистую 2 н. кислоту, а в катодном пространстве — раствор щелочи. При этом в качестве катода можно использовать обычную сталь.
Хотя хлорная кислота, полученная электрохимическим окислением растворов НС1 или С12 в НС104, используется для производства различных перхлоратов, часто с успехом применяется также и обратный процесс — получение хлорной кислоты из перхлоратов щелочных или щелочноземельных металлов. В этом случае исходным сырьем обычно служит перхлорат натрия, получаемый электрохимическим окислением хлората натрия. Иногда перхлорат
 |
натрия переводят в перхлораты калия, бария или других металлов обменным разложением.
Рис.8. Трехкамерный электролизер:
/ — анодная камера; 2 — пористая диафрагма, 3 — центральная камера; 4 — катионообменная мембрана; 5 — катодная камера; 6 — катод; анод; 8, 9 — соответственно катодная и анодная шины.
Один из первых промышленных методов получения хлорной кислоты был основан на реакции между перхлоратом калия и серной кислотой
КС1O4 + H2S04 = НС104 + KHS04 (3)
Хлорную кислоту отгоняли дистилляцией в вакууме. При этом в случае применения достаточно концентрированной серной кислоты получали хлорную кислоту высокой концентрации, близкую к безводной. Реализация этого процесса в промышленности связана со сложностью аппаратурного оформления, ограниченностью материалов, пригодных для работы в среде хлорной и серной кислот, и необходимостью проведения отгонки хлорной кислоты в вакууме. Поэтому применение процесса целесообразно только для получения безводной хлорной кислоты. Для получения водных растворов хлорной кислоты предложено взаимодействие перхлората калия с кремнефтористоводородной кислотой в водном растворе
КС104 + HsiF6 = НС104 + KsiF6 (4)
При этом помимо растворов хлорной кислоты получают осадок плохо растворимого кремнефторида калия. После фильтрования осадка разбавленные растворы хлорной кислоты можно подвергать концентрированию и затем возгонке в виде азеотропной кислоты концентрацией около 72%. Однако получаемые осадки кремнефторида калия плохо фильтруются, что затрудняет практическое использование этого метода.
Для получения безводной хлорной кислоты, помимо указанного взаимодействия солей хлорной кислоты с сильными неорганическими кислотами, применяют перегонку в вакууме смеси технической, примерно 70%-ной хлорной кислоты с трех—четырехкратным по объему количеством дымящейся серной кислоты.
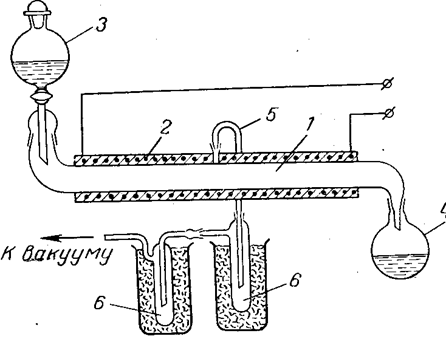
Предложен непрерывный процесс получения безводной хлорной кислоты обезвоживанием азеотропа олеумом с вакуумной отгонкой. Схема такой установки показана на рис. 10. На рисунке изображена лабораторная установка, однако по такому же принципу может быть создана и более крупная установка. В самом аппарате всегда находится небольшое количество подвергаемой обработке смеси кислот, что уменьшает опасность, связанную с возможными взрывами. При смешении кислот требуется охлаждение смесителя во избежание перегрева и возможного термического разложения хлорной кислоты.
|
|
Рис. 10. Схема установки для получения безводной хлорной кислоты:
1 — труба из кварцевого стекла или пирекса;
2 — электрообогрев; з — капельная воронка;
4 — приемник отработанной смеси кислот;
5 — трубка для отвода паров хлорной кислоты;
6 — приемник-конденсатор безводной хлорной кислоты.
7. ПД – ПОРТРЕТ ЭХО.
1998 год 9Л248П Пат. 2086706 Россия, МКИ6 с 25В1/22, 1/26. Алиев З.М. Дагестан. университет им. Ленина №94018915/25 Заявл 25.5.94. Опубл. 10.8.97 Бюл №22
Способ получения хлорной кислоты путем электрохимического окисления CL2 на платиновом аноде в растворе 0.1 М HCL и 4М хлорной кислоты при температуре 00 и анодной плотности тока 0.4-0.7 А/см2 отличается тем, что процесс ведут в без диафрагменном электролизере с графитовым катодом с последовательным насыщением раствора CL2 под давлением 0.3-0.6МПа и О2 под давлением 4-5МПа при катодной плотности тока 8-10мА-см2.
1998год 15Л215П. Система электролизеров фильтр-прессного типа.Elektrolyserellenanordnung in Filterpressenbauart: Заявка 4325705. Германия, МКИ6 с 25 В13/001. Kreuter Walter, Linde AG.№ 4325705.4; Заявл. 30.7.93; Опубл .2.2.95.
Предложена система электролизеров фильтр – прессного типа, состоящая из большого числа последовательно соединенных электролизеров с анодным и катодным пространствами , разделенными диафрагмами. Электролизеры отделены друг от друга непроницаемыми перегородками из листового материала, образующими биполярные Э. Данные перегородки изготовленные из Ni, образуют также жесткую конструкцию с перфорированными и волнистыми перегордками, изготовленными из этого же металла. Конструкция данной системы электролизеров отличается прочностью. Приведена и описана схема системы Ф. Л. Чернович.
8. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ.
1.Л. М. Якименко, Г. А. Серышев. “Электрохимический синтез неорганических.” М. “Химия” 1984 г.
2. Л. М. Якименко, “Справочник по производству хлора, каустической соды и основных хлорпродуктов.” М. “Химия” ,1974 г.
3. Л. М. Якименко, М.И.Пасманик. “Справочник по производству хлора, каустической соды и основных хлорпродуктов.” Изд. 2-е, пер. и доп. М.,. “Химия” 1976 г.
4. “Справочник по электрохимии” Под ред. А. М. Сухотина.-Л.: Химия, 1981 г.
5. М. Я. Фиошин, В. В. Павлов. “Электролиз в неорганической химии.” М. 1976 г