
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология и педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по информатике программированию
Краткое содержание произведений
Реферат: Библиотека структурных гетероциклических аналогов, содержащих имидный и сульфонильный фрагменты
Реферат: Библиотека структурных гетероциклических аналогов, содержащих имидный и сульфонильный фрагменты
М. В. Дорогов, Л. А. Савватеева, И. В. Тюнёва
В последние годы проводится все больше исследований, связанных с разработкой методов синтеза органических соединений, обладающих определёнными типами биологической активности и являющихся разнообразными лекарственными препаратами [1,2]. Согласно литературным данным, предпочтение в этих исследованиях отдается гетероциклическим системам, содержащим атомы кислорода, серы, азота и широкое разнообразие функциональных заместителей [3-5]. Одна из причин использования гетероциклических соединений - это широкие возможности их структурной модификации, а, следовательно, получение соединений с новым комплексом биохимических свойств. Одним из вариантов модификации гетероциклических структур является введение различных фрагментов и функциональных групп в качестве заместителей. Поэтому для современной медицинской химии особый интерес представляют комбинаторные библиотеки структурных аналогов с однотипным гетероциклическим скелетом и варьирующимися фрагментами и функциональными группами.
Целью данной работы являлось генерирование библиотеки структурных аналогов гетероциклического типа, содержащих одновременно имидный и сульфонильный фрагменты, идентификация синтезированных соединений и компьютерная оценка их биологической активности с помощью системы PASS [6,7].
Известно, что оба вышеупомянутых структурных фрагмента используются в направленном поиске биологически активных препаратов. Так, в частности, известен имидосодержащий препарат СЕДИЕЛ(r), являющийся эффективным антидепрессантом, а ароматические сульфокислоты считаются перспективными билдинг-блоками для получения различных химиотерапевтических средств [8,9].
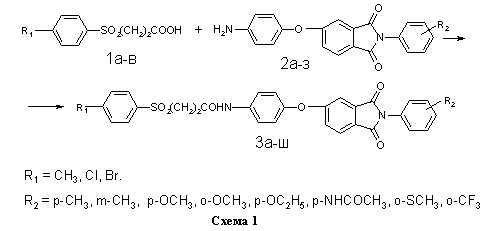
На схеме 1 представлена реакция получения библиотеки структурных аналогов с имидным и сульфонильным фрагментами 3а-ш. В качестве реагентов были использованы ароматические сульфопропионовые кислоты 1а-в и аминофенокси-N-фенилфталимиды 2а-з (таблица).
Соединения 1a-в получали на основе толуола, хлор- и бромбензола по методикам, изложенным в работах [10,11] (схема 2).
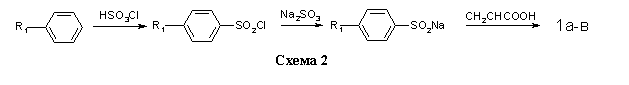
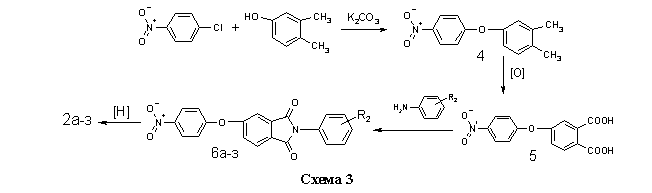
Соединения 2а-з получали на основе п-нитрохлорбензола и 3,4-ксиленола, через стадии образования 4-нитро-3/,4/диметилдифени-локсида 4, 4-нитрофеноксифталевой кислоты 5 и нитрофенокси-N-фенилфталимидов 6а-з (схема 3) по методикам, изложенным в работах [12,13].
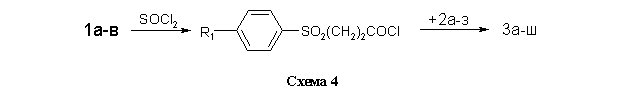
Для получения библиотеки структурных аналогов 3а-ш использованы две метода ацилирования аминов 2а-з. В первом случае (метод А, см. Экспериментальную часть) в качестве активированного ацилирующего агента использовались хлорангидриды кислот, полученных обработкой 1а-в тионилхлоридом в бензоле (схема 4).
Во втором случае (метод Б, см. Экспериментальную часть) в качестве электрофильного ацилирующего агента использовались не хлорангидриды кислот 7а-в, а их имидазолилы 8а-в, полученные взаимодействием 1а-в с N,N-карбонилдиимдазолом 9 в безводном диоксане. Ввиду малой основности 9 и слабого характера амидной связи в имидазолилах 8а-в, последние легко вступают в реакцию переамидизации с аминами 2а-з (схема 5).
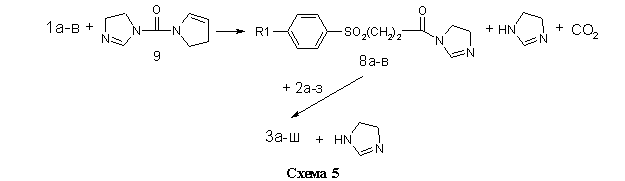
Данный метод находит в последнее время всё большее использование в органическом синтезе. Его очевидным преимуществом является отсутствие необходимости в использовании высокотоксичного тионилхлорида для получения активного ацилирующего агента и лёгкость очистки целевого продукта от побочного имидазола.
Таблица
| Соединение | R1 | R2 | Метод получения и способ очистки | Выход, % | Температура плавления, °С |
| 1а | CH3 | [10,11], кр. из этанол+вода | 80 | 113...5 | |
| 1б | Cl | - | 75 | 145...6 | |
| 1в | Br | - | 80 | 154...6 | |
| 2а | p-CH3 | [12,13 ] | 70 | 181...3 | |
| 2б | m-CH3 | - | 75 | 166...8 | |
| 2в | p-OCH3 | - | 75 | 194...5 | |
| 2г | o-OCH3 | - | 70 | 202...4 | |
| 2д | p-OC2H5 | - | 75 | 195...7 | |
| 2е | p-NHCOCH3 | - | 65 | 198...200 | |
| 2ж | o-SCH3 | - | 70 | 158...9 | |
| 2з | o-CF3 | - | 70 | 190...3 | |
| 3а | CH3 | p-CH3 | А, крист. в этаноле | 80 | 257...8 |
| 3б | - | m-CH3 | - | 80 | 187...9 |
| 3в | - | p-OCH3 | 85 | 222...4 | |
| 3г | - | o-OCH3 | А, крист. в изопропаноле | 75 | 253...6 |
| 3д | - | p-OC2H5 | Б, крист. в изопропаноле | 75 | 201...4 |
| 3е | - | p-NHCOCH3 | Б, крист. в пропанол+ДМФА | 70 | 260...2 |
| 3ж | - | o-SCH3 | Б, экстр. бензолом | 80 | 219...21 |
| 3з | - | o-CF3 | - | 85 | 197...9 |
| 3и | Cl | p-CH3 | А, крист. в этаноле | 85 | 202...4 |
| 3к | - | m-CH3 | - | 80 | 184...6 |
| 3л | - | p-OCH3 | - | 85 | 269...71 |
| 3м | - | o-OCH3 | А, крист. в диоксан+вода | 80 | 225...7 |
| 3н | - | p-OC2H5 | Б, крист. в диоксан+вода | 70 | 259...61 |
| 3о | - | p-NHCOCH3 | Б, крист. в пропанол+ДМФА | 70 | 272...5 |
| 3п | - | o-SCH3 | Б, крист. в изопропаноле | 75 | 178...80 |
| 3р | - | o-CF3 | Б, крист. в изопропаноле | 70 | 185...7 |
| 3с | Br | p-CH3 | А, экстр. диэтил. эфиром | 75 | 253...7 |
| 3т | - | m-CH3 | А, экстр. диэтил. эфиром | 70 | 212...4 |
| 3у | - | p-OCH3 | А, крист. в диоксан+вода | 65 | 265...7 |
| 3ф | - | o-OCH3 | А, крист. в диоксан+вода | 65 | 137...9 |
| 3х | - | p-OC2H5 | Б, крист. в изопропаноле | 70 | 249...50 |
| 3ц | - | p-NHCOCH3 | Б, крист. в пропанол+ДМФА | 70 | 279...82 |
| 3ч | - | o-SCH3 | Б, экстр. бензолом | 75 | 164...7 |
| 3ш | - | o-CF3 | - | 80 | 209...11 |
В общей сложности, в данной работе было синтезировано 24 не описанных ранее в литературе соединения 3а-ш, содержащих имидный и сульфонильный фрагменты. Их структура, методы получения и очистки, выход и температура плавления представлены в таблице. Выход 1а-в дан в расчёте на исходное бензольное производное (схема 2), выход 2а-з дан в расчёте на кислоту 5 (схема 3), выход 3а-ш дан в расчёте на кислоту 1а-в (схема 1).
Для первоначальной оценки биологической активности полученных соединений проведено компьютерное моделирование с помощью системы PASS, позволяющей выполнить прогноз более 500 видов биологической активности исходя из структурной формулы химического соединения и другой эмпирической информации [6,7]. Оптимальное сочетание предсказательных индексов биологической активности (Ра) и инактивности (Рi) в отношении к определённому фармакологическому эффекту получено (в рамках системы PASS) для 3г (Ра=0,512; Рi=0,064; антиконвульсант), 3ф (Ра=0,505; Рi=0,072; антагонист рецепторов GABA), 3ч (Ра=0,584; Рi=0,049; активатор калиевых каналов).
Таким образом, в результате проведённой экспериментальной работы на основе различных карбоновых кислот синтезированы библиотеки структурных аналогов гетероциклического типа, содержащих одновременно имидный и сульфонильный фрагменты. Строение и чистота синтезированных соединений подтверждалась определением температуры плавления, методом тонкослойной хроматографии, ИК- и ПМР-спектроскопией. Проведённое компьютерное моделирование позволило выявить факт влияния структурных параметров на биологическую активность полученных соединений. Ряд синтезированных соединений передан для дальнейших исследований в Институт физиологически активных веществ РАН.
Работа проводилась при поддержке предприятия "Контакт-Сервис" (Москва). Авторы выражают благодарность доценту кафедры медицинской химии МГУ С. Е. Ткаченко за ценные советы при подготовке публикации.
Экспериментальная часть
Реакцию получения 3а-ш проводили через стадию образования активных ацилирующих агентов двумя методами.
Метод А (через хлорангидриды кислот 1а-в). Синтез хлорангидридов 7а-в проводили путем кипячения исходной кислоты в тионилхлориде в присутствии каталитических количеств ДМФА в течение 1 ч с последующей отгонкой тионилхлорида. В качестве растворителя для реакции получения целевых амидов 3 использовали безводный ДМФА, в который добавляли пиридин в шестикратном мольном избытке по отношению к хлорангидриду 7а-в. Роль пиридина заключалась в связывании хлористого водорода, выделяющегося в процессе реакции. Это препятствовало протеканию побочной реакции хлористого водорода с исходным амином. Реакцию проводили при эквимолярном соотношении хлорангидрида 7 и амина 2 и температуре 10...40 оС в течение 3 ч. Охлаждённую реакционную массу выливали в воду, выпавший осадок фильтровали. Продукт сушили, кристаллизовали (или экстрагировали) и анализировали.
Метод Б (через амиды кислот 1а-в с N,N-карбонилдиимдазолом). Синтез амидов 8а-в проводили следующим образом. В стеклянную колбу, снабженную мешалкой, холодильником и термометром, загружали 1 и 9 в соотношении 1.0:1.2 (моль) и диоксан из расчёта 1 г 9 - 1 мл диоксана. Реакцию проводили при постоянном перемешивании, температуре 40...500С в течение 1 часа. Далее в колбу загружали амин 2 в соотношении 1:2=1:0,95 (моль). Амин использовали в небольшом недостатке по отношению к кислоте, исходя из того, что дальнейшая очистка от исходного амина проходит труднее, чем от исходной кислоты. Реакцию проводили при кипении диоксана в течение 1 ч. Охлаждённую реакционную массу выливали в 5%-ный раствор соды, выпавший осадок фильтровали. Продукт сушили, кристаллизовали (или экстрагировали) и анализировали.
Ход реакции 2а-з с ацилирующими агентами 1а-в контролировали методом ТСХ на пластинках Silufol 254 UV c использованием элюента петролейный эфир - бензол - ацетон - уксусная кислота - 10:5:10:0.5 (об). Для целевых амидов 3а-ш в указанном элюэнте Rf составляет 0.45...0.55.
ИК-спектры записывали на приборе UR-20. Анализируемые вещества находились в виде суспензии в вазелиновом масле, тонким слоем нанесенной на призму из хлористого или бромистого натрия. Отнесение полос поглощения проводили согласно имеющимся литературным данным [14]. Для ИК-спектров целевых амидов 3а-ш характерными являются полосы поглощения в области (см-1) 3270 (N-H), 1765, 1700 (C=O имид), 1655, 1530 (C=O амид), 1240 (С-О-С).
Спектры ЯМР 1Н 5 %-ных растворов образцов в ДМСО-d6 с внутренним стандартом ТМС записаны на приборе "Brucker-AC-400P" в ИОХ РАН (Москва). Для ЯМР спектров амидов 3а-ш характерно наличие сигналов протонов ароматических ядер (6,5-8.5 м.д) и два триплета в области 3,9 и 3,7 м.д., соответствующие двум -СН2- группам. Для протона -NH- группы характерен синглет в области 10-11 м.д.
Список литературы
Зефирова О. Н., Зефиров Н. С. Медицинская химия (Medicinal chemistry). 1. Краткий исторический очерк, определения и цели // Вестн. Моск. ун-та. Сер.2. Химия. 2001. Т. 41. С. 43-47.
Стратегия и тактика орг. синтеза // III Всерос. симп. по орг. химии. 3-6 марта 2001г. Ярославль, 2001.
Машковский М. Д. Лекарственные средства. 12-е изд., перераб. и доп. М.: Медицина, 1993. 335 с.
Джилкрист Т. Химия гетероциклических соединений: Пер. с англ. / Под. ред. М. А. Юровской. М.: Мир, 1996. 463 с.
1 Всерос. конф. по химии гетероциклов памяти А. И. Коста // 19-23 сент. 2000 г. Суздаль. М., 2000.
Филимонов Д.А., Поройков В.В. Компьютерная оценка свойств химических соединений с помощью системы PASS // Хим.-фарм. ж. 1998. Т.32. С. 32-39.
Филимонов Д. А., Поройков В. В. Средняя точность прогноза при оценке фармакологических эффектов ряда биологически активных веществ с помощью системы PASS // Вопросы мед. химии. 1997. Т. 43. С. 41-57.
Зефирова О. Н., Зефиров Н. С. Медицинская химия (Medicinal chemistry). 2. Методологические основы создания лекарственных препаратов. // Вестн. Моск. ун-та. Сер.2. Химия. Т. 41. №2. С.103-108.
Яхонтов Л. Н., Глушков Р. Г. Синтетические лекарственные средства. М.: Медицина, 1983. 273 с.
Фельдман И. Х., Михайлова В. Н. Синтез ароматических сульфопропионовых и сульфоуксусных кислот // Журн. общ. хим. 1963. №7. С.2111-2114.
Органикум.: Практикум по органической химии. Т.2: Пер. с нем. / Под ред. В. М.Потапова и С.В.Пономарева. М.: Мир, 1979. С.257.
Dorogov M. V., Nosova G. I., Koshel G. N. et al. Synthesis of multinuclear asymmetrical diamines based on 4-(nitrophenoxy)phthalic asids // Mendeleev Comm. 1997. Nr.1. Р.38-40.
Дорогов М.В., Буданов Н.А., Лебедева Н.А. и др. Окисление (нитрофенокси)-о-ксилолов до нитрофеноксифталевых кислот // Журн. прикл. химии. 1997. Т.70. Вып.10. С.1694-1697.
Наканиси К. Инфракрасные спектры и строение органических соединений: Пер с англ. М.: Мир, 1965. 191 с.
Для подготовки данной работы были использованы материалы с сайта http://www.yspu.yar.ru