
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология и педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по информатике программированию
Краткое содержание произведений
Реферат: Брахитерапия в лечении рака предстательной железы
Реферат: Брахитерапия в лечении рака предстательной железы
РЕФЕРАТ
Метод брахитерапии в лечении рака предстательной железы.
Содержание
- введение
- классификация
- патологоанатомическая классификация
Симптомокомплекс РПЖ -
- Ограниченно-местный РПН
- Диссеминированный РПЖ
Диагностика РПЖ
Лечение РПЖ
- Лучевая терапия
- Гормональная терапия
- Комбинированная терапия
Брахитерапия
- Техника брахитерапии
- Показания и противопоказания
- Планирование
- Процедура иммплантацции
- Оценка результатов
- Сравнительная хаарактеристика
- Заключение
Список литературы
Диагностика РПЖ
С целью выявления рака предстательной железы принято проводить три необходимых исследования:
I. Пальцевое исследование простаты.
II.Определение уровня простато-специфического антигена (ПСА).
III.Ультразвуковое исследование (УЗИ) простаты, при показаниях - одновременно с биопсией.
Пальцевое исследование прямой кишки.
В результате пальпации врач может выявить следующие симптомы опухоли предстательной железы:
Асимметричная предстательная железа. Плотной или деревянистой консистенции части предстательной железы. Плотность может определяться в виде отдельных узлов, либо различной величины инфильтратов, вплоть до перехода их на стенки таза. Неподвижность железы вследствие сращения её с окружающими тканями.
Данные, полученные при пальпации, не всегда легко интерпретировать, так как ложно - положительный диагноз рака предстательной железы возможно поставить при других заболеваниях:
· Доброкачественная гиперплазия предстательной железы
· Камни предстательной железы .
· Простатит.
· Флеболиты стенки прямой кишки
· Полипы или рак прямой кишки.
· Аномалии семенных пузырьков.
Результаты пальпации безусловно очень трудно дифференцировать от перечисленных заболеваний, но зато они являются вескими основаниями для дальнейшего обследования больного. В среднем только у одной трети случаев пальпируемых узлов предстательной железы впоследствии гистологически верифицируют рак простаты.
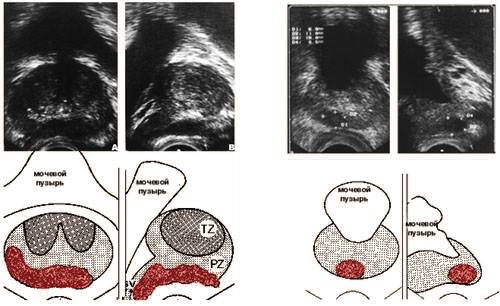
Трансректальная
ультразвуковая томография.
Опухоль предстательной железы.
Лечение РПЖ
Радикальная простатэктомия выполняется из позадилобкового или трансперинеального доступа. В понятие радикальной простатэктомии укладывается полное удаление предстательной железы с семенными пузырьками, терминальными отделами семявыбрасывающих протоков и краями шейки мочевого пузыря. До удаления предстательной железы обычно выполняется тазовая лимфаденэктомия со срочным гистологическим исследованием удаленных лимфоузлов. В случае обнаружения метастатического процесса в удаленных лимфоузлах удаление предстательной железы, как правило, не проводится. Послеоперационная смертность по данным большинства зарубежных авторов составляет 1-2%.
Отдаленные результаты операции зависят от точности дооперационного стадирования. Окончательный ответ по распространенности опухоли дает послеоперационное гистологическое исследование удаленного препарата (рТ).
В кооперированных исследованиях было показано, что 10 и 15-летняя выживаемость после радикальной простатэктомии, соответственно, составляет 75 и 60%.
Осложнения радикальной простатэктомии.
· Кровопотеря 800-1400 мл.
· Импотенция 60%-80%
· Недержание мочи 15-20%
· Стриктура уретры 7%-9%
· Флеботромбозы 1-8%
· Тромбоэмболия легочной артерии менее 1%
· Повреждение прямой кишки менее 1%
· Послеоперационная летальность 0,2-2%
Лучевая терапия
В настоящее время для лечения злокачественных опухолей предстательной железы применяются три вида лучевой терапии:
· Дистанционная
· Интерстициальная
· Радионуклидная
Дистанционная лучевая терапия может применяться при любой распространенности опухолевого процесса:
· В самостоятельном варианте по радикальной программе при T1-2,N0,M0
· Как этап комбинированного лечения при T1-3,N0,M0; после операции радикальной простатэктомии
· Лучевая терапия с паллиативной целью при T1-4,N0-1,M1
Методики и схемы лучевой терапии
Дистанционная лучевая терапия по радикальной программе
Лучевая терапия клинически локализованного рака предстательной железы применяется у пациентов с противопоказаниями для хирургического лечения. Накоплен значительный опыт по применению дистанционной лучевой терапии у пациентов с локальными формами заболевания. Современные технологии дозиметрии и топометрии позволяют подвести в течение 6-7 недель суммарную очаговую дозу на область предстательной железы в размере 70-75 Гр. Получение 3-хмерного изображения предстательной железы позволяет избежать значительного повреждения соседних органов и тканей. Наибольшее число специалистов используют методику 4-польного облучения и разовую очаговую дозу 2-2,5 Гр.
Осложнения лучевой терапии
· Импотенция 55-67%
· Кровотечения из прямой кишки 5,4%
· Диарея 3,6%
· Гематурия 5,1%
· Стриктура уретры 5,4%
· Ректальные повреждения менее 1%
· Недержание мочи 0,4-4%
· Летальность менее 0,01%
Гормональная терапия
В 1941 году Huggins и Hodges предложили выполнение билатеральной орхиэктомии у больных метастатическим раком предстательной железы. Несмотря на то, что прошло более 50 лет после внедрения этого вмешательства, эта операция осталась "золотым" стандартом в лечении больных распространенным раком. Все эти годы проводились многочисленные исследования по разработке методов медикаментозной кастрации. Сердечно-сосудистые осложнения эстрогенотерапии значительно снизили частоту их применения и привели к открытию нового класса препаратов - антиандрогенов. Антиандрогены различаются по своему строению и механизму действия и делятся на две группы - нестероидные и стероидные. К нестероидным антиандрогенам относятся флуцином, анандрон, касодекс, а к стероидным - андрокур и мегестрола ацетат. Разработка и внедрение агонистов LHRH гормонов (Бусерелин, Золадекс, Декапептил и др.) позволило заменить билатеральную орхиэктомию химической кастрацией вышеуказанными препаратами. Механизм их действия связан с блокадой рецепторов на уровне опухолевой клетки-мишени, что в последующем тормозит конверсию тестостерона в дегидротестостерон.
Предложенный в 1983 году Labrie и соавт. метод максимальной блокады андрогенов (МАБ) вселил оптимизм и позволил повысить выживаемость больных метастатическим раком.
Комбинированная терапия
Комбинация аналогов LHRH гормонов (орхиэктомия) и антиандрогенов является основным методом лечения больных распространенным раком предстательной железы
Исследования последних лет показали преимущества использования неоадъювантной гормонотерапии с лучевой терапией. Лучевая терапевтическая онкологическая группа (RTOG) провела кооперированное исследование и сравнила результаты только лучевой терапии и комбинации лучевой терапии и гормонотерапии у больных раком предстательной железы в стадии Т3-Т4. Через 5 лет прогрессирование у больных после лучевой терапии возникло в 71% случаев, а в группе, где проведено комбинированное лечение, только у 46% пациентов. Аналогичные результаты получены в других кооперированных исследованиях, что подтверждает эффективность комбинированной терапии у больных местнораспространенным раком предстательной железы.

Введение
За последние годы отмечен резкий рост злокачественных новообразований предстательной железы.
В высокоразвитых странах Северной Америки и Европы эта опухоль занимает 1-2 место по частоте встречаемости среди всех новообразований у мужчин. В странах СНГ за период 1989-1996 гг. уровень стандартизованного показателя возрос на 6,2% и составляет 11,3 на 100 тысяч мужского населения.
В 1996 году выявлено 8290 новых случаев заболевания. В среднем ежедневно в регистрируется 23 случая рака предстательной железы .
Течение и прогноз заболевания тесно связаны с распространенностью злокачественного процесса, т.е. стадией заболевания, которая устанавливается после проведенного обследования. В 1997 г. Международным противораковым комитетом (UICC) предложена новая TNM классификация злокачественных
опухолей.
Классификация
Т - первичная опухоль
Тх - первичная опухоль не может быть определена
То - нет признаков первичной опухоли
Т1 - клинически не определяемая опухоль, не пальпируемая и невидимая при аппаратном исследовании
Т1а - опухоль, обнаруженная случайно при гистологическом исследовании <5% резецированного материала
Т1b - опухоль, обнаруженная случайно при гистологическом исследовании >5% резецированного материала
Т1c - опухоль, идентифицируемая при игольчатой биопсии
Т2 - опухоль, ограниченная пределами железы
Т2а - опухоль занимает половину доли или менее
Т2b - опухоль занимает более половины доли, но не обе
Т2с - пухоль занимает обе доли
Т3 - опухоль выходит за пределы капсулы
Т3а - одностороннее распространение через капсулу
Т3б - двустороннее проникновение опухоли за капсулу
Т3с - опухоль распространяется на семенные пузырьки
Т4 - опухоль фиксирована или проникает в другие органы ( шейку мочевого пузыря и/или наружный сфинктер, прямую кишку , на поднимающие мышцы и/или фиксирована к стенке таза)
N - Региональные лимфоузлы
Nx – региональные лимфоузлы не могут быть оценены
No - отсутствие метастазов в региональные лимфатические узлы
N1 - метастазы в регионарных лимфатических узлах (узле)
М - Отдаленные метастазы
Mx - наличие отдаленных метастазов не может быть оценено
Мo - отсутствие отдаленных метастазов
М1 – отдалённые метастазы
М1a – отдалённые лимфоузлы
М1b - кости
М1c - другие локализации
Патологическая классификация
pT - Первичная опухоль
pT2 - ограничена органом
pT2a - одной долей
pT2b - обе доли
pT3 - экстрапростатический рост
pT3a - экстрапростатический рост
pT3b - прорастание семенных пузырьков
pT4 - прорастание мочевого пузыря, прямой кишки
*категория рТ1 отсутствует
Группировка по стадиям
Стадия I T1a N0 M0 G1
Стадия II T1a N0 M0 G2, 3-4
T1b N0 M0 любая G
T1c N0 M0 любая G
T1 N0 M0 любая G
T2 N0 M0 любая G
Стадия III T3 N0 M0 любая G
Стадия IV T4 N0 M0 любая G
любая T N1 M0 любая G
любая T любая N M1 любая G
Гистопатологическая дифференцировка
Gx - степень дифференцировки не может быть определена
G1 - высокая степень дифференцировки (лёгкая анаплазия)
G2 - средняя степень дифференцировки (средняя анаплазия)
G3-4 - низкая степень дифференцировки или недифференцированные опухоли (выраженная анаплазия)
Симптомокомплекс РПЖ
Симптомокомплекс рака предстательной железы имеет множества различных проявлений тем не менее он связан с двумя основными проявлениями болезни. Во-первых, симптомы обструкции мочевого пузыря ( учащенное и затрудненное мочеиспускание, вялая струя и т.д.); во-вторых, симптомы болезни вызванные распространением опухоли ( гематурия и боль ). Условно симптомы рака предстательной железы можно разделить на характерные для ограниченного заболевания и для местно-распространённого опухолевого процесса.
Основные симптомы рака предстательной железы (N. Schmeller at al.)
|
pTNM |
T1N0M0 |
T2N0M0 |
T3/4N0M0 |
T_N+M0 |
T_N_M1 |
S |
возраст |
|
Дизурия |
9,6 |
23,6 |
44,3 |
6,8 |
15,7 |
100 |
71,4 |
|
Гематурия |
7,6 |
22,8 |
49,4 |
7,6 |
12,7 |
100 |
72,2 |
|
Костные боли |
0,0 |
2,6 |
6,9 |
0,9 |
89,7 |
100 |
69,3 |
|
Неспецифические синдромы |
9,2 |
30,8 |
37,1 |
6,8 |
16,7 |
100 |
68,6 |
|
Скрининг обследование |
8,0 |
37,0 |
45,5 |
5,6 |
3,9 |
100 |
67,1 |
|
ОЗМ |
47,4 |
23,7 |
20,3 |
3,3 |
5,9 |
100 |
72,4 |
|
Без клинических проявлений |
11,1 |
28,4 |
42,0 |
7,4 |
11,1 |
100 |
69,2 |
n-rколичество больных по каждой группе жалоб всего больных 3180
Из приведенной таблицы видно , что симптомы обструкции мочевого пузыря при раке предстательной железы встречаются довольно часто. Это связано с тем, что основной контингент больных встречается в возрасте за 60 лет и нередко у них имеется сопутствующая доброкачественная гиперплазия предстательной железы. Выраженность симптомов обструкции (вялая струя, затрудненное мочеиспускание и т.д.) напрямую связана со степенью сдавления опухолью мочеиспускательного канала. Сама по себе обструкция мочевого пузыря может вызвать и сопутствующую симптоматику - повторяющиеся воспаления мочевых путей, которые могут проявляться также болезненным частым мочеиспусканием. В зависимости от величины сдавления может возникнуть хроническая задержка мочи. Чем больше сдавление, тем выраженее симптомы обструкции.
Симптомы раздражения мочевых путей (учащенное мочеиспускание, невозможность сдержать мочеиспускание), возникают в результате нестабильности самого детрузора в результате обструкции. Все описанные симптомы могут быть вызваны вовлечением в опухолевый процесс тазовых нервов и мочеиспускательного треугольника.
Симптомы ограниченного и местно-распространенного РПЖ.
Симптомы обструкции мочевыводящих путей, как было отмечено выше, встречаются довольно часто и обычно сопровождаются рядом других проявлений болезни. Так, при прорастании опухолью простатической части уретры возникает гематурия и болезненное мочеиспускание. В том же случае, если в опухолевый процесс вовлекается сфинктер мочеиспускательного канала, развивается недержание мочи. В подобной ситуации врачу необходимо дифференцировать недержание мочи из-за хронической задержки и переполнения мочевого пузыря с опухолевым поражением сфинктера. При хронической задержке все симптомы возможно устранить при помощи трансуретральной резекции предстательной железы..
Прорастание опухоли в окружающие ткани может вовлечь и сосудисто-нервный пучок, проходящий вдоль боковой поверхности простаты, что в свою очередь может сказаться на потенции больного. Вовлечение в опухолевый процесс промежуточного или надлобкового нерва чаще всего вызывает боли в промежности. Этот возможный вариант возникновения болей необходимо учитывать, когда речь идет о подозрении на простатит.
Местно-распространенный рак предстательной железы может прорасти в дистальный отдел прямой кишки и сдавить её просвет. В подобных случаях заболевание будет проявляться запорами, тенезмами кровотечениями, выделением слизи из прямой кишки; возможна клиника толстокишечной непроходимости.
Диссеминированный рак предстательной железы.
Появление отдаленных метастазов рака предстательной железы меняет и клиническое проявление болезни.
В странах СНГ до 70% больных раком предстательной железы обращаются к врачу уже в 3-4 стадии заболевания, при наличии метастазов. Основной симптом, который заставляет больного обращаться к врачу - это боли, которые появляются при метастазах в кости. Локализация болей обычно соответствует локализации метастазов, за исключением конечностей, где боли, могут быть проводниковыми из-за сдавления нервных корешков при метастатическом поражении позвоночника. Боли имеют тенденцию постепенно усиливаться. Особенно резкие боли возникают при патологических переломах, например шейки бедра. Метастазы в позвоночнике могут привести к сдавлению спинного мозга, что в свою очередь может вызвать параплегию.
У некоторых больных клинические проявления заболевания определяются метастазами в лимфатические узлы. На первых порах увеличиваются запирательные и внутренние подвздошные лимфатические узлы, которые по мере роста опухоли вовлекают в процесс окружающие органы и ткани - уретру, мочевой пузырь, мочеточники. Соответственно и клиническое проявление болезни определяется степенью вовлечения перечисленных органов в опухолевое поражение. Например, сдавление или прорастание мочеточников, может вызвать обструкцию мочеточников, что в свою очередь может привести к анурии. Диссеминация опухоли может привести к поражению практически любой группы лимфатических узлов: шейных, паховых, надключичных, подвздошных и т.д. Состояние больного постепенно ухудшается, наступает кахексия, дизурия, кровотечения. В начальных стадиях рак предстательной железы практически клинически не проявляется, и его выявляют обычно случайно(у 5-10 % мужчин), после операции по поводу доброкачественной гиперплазии простаты( трансуретральной резекции простаты, чреспузырной аденомэктомии).
Брахитерапия.
Брахитерапия рака предстательной железы впервые была представлена много лет назад: вначале Pasteu and Degrais в 1910 г. сообщили об использовании радиевых иголок и затем Flocks и соавторами в 1930 г. применили в качестве имплантанта радиоактивное золото. Возрождение брахитерапии (БТ) простаты началось в 1970 г. с развитием технологии ретропубикальной открытой имплантации зерен I-125 в Мемориальном Госпитале Нью-Йорка. Технология появилась как альтернатива радикальной простатэктомии, но затем была забыта до конца 1980 х годов из-за не вполне удовлетворительных клинических результатов.
Основной причиной неудач явилось то, что при открытой ретропубикальной технологии зерна йода располагались мануально вследствие чего не достигалось оптимального распределения дозы в предстательной железе: наряду с зонами чрезмерной активности оставались холодные очаги. Расчет и распределение дозы при начальном использовании метода были довольно приблизительными, так как не использовались компьютерные алгоритмы для точного определения дозы и расположения зерен. Наблюдение за пациентами после ретропубикальной технологии имплантации показало не только болезненность и травматизм в результате наличия очагов повышенной активности, но также и частые рецидивы, о чем с появлением теста на ПСА свидетельствовал его повышенный уровень.
Техника открытого хирургического вмешательства также значительно повышает травматичность процедуры имплантации зерен. Кроме того, даже в тех случаях когда достигались хорошие клинические результаты, было сложно убедиться в правильном расположении зерен. В результате метод брахитерапии рака простаты был на некоторое время забыт.
Новая техника брахитерапии
В 1981 г. Holm and Gammergaard описали технологию трансректального доступа под контролем ультразвука с использованием специального шаблона, который позволяет точно располагать иглы внутри простаты. Это методика впервые была применена для получения биопсии и стало очевидным, что она может использоваться для визуализации положения радиоактивных источников в простате.
Это и послужило основой новой технологии брахитерапии. Процедура включает две стадии.
Первая - использование трансректального УЗИ для определения объема простаты и получения информации с координат шаблона для расчета количества и положения радиоактивных источников, необходимого для достижения равномерной дозы радиации в предстательной железе.
На второй стадии источники вводятся в простату через специальные иглы с использованием шаблонной сетки. Иглы вводятся через кожу промежности закрытым способом.
Общая доза радиации в простате и ее распределение рассчитываются компьютерной программой.
I-125 Rapid Strand
Введение постоянных имплантантов (I-125) является самой распространенной формой БТ. При постоянной имплантации источники остаются в простате и обеспечивают радиацию в течение нескольких недель или месяцев. I-125 имеет период полураспада 60 дней и обычно рекомендованная минимальная периферическая доза составляет 160 Гр на объем, который включает капсулу простаты плюс 2 или 3 мм запаса. Это значит, что 80 Гр доставляется в первые 60 дней и остальное в уменьшающейся дозе в течение следующих 4-6 месяцев.
I-125 имеет энергию 27-35 Кэв. Низкая энергия означает, что имеется низкий уровень проникновения в ткани что соответствует обратному закону квадратов о дозе уменьшающейся на 50% от минимальной периферической дозы. Это обеспечивает значительное преимущество с точки зрения уменьшения дозы в прилегающих критических структурах таких как прямая кишка и нейроваскулярные пучки.
Существует два основных типа имплантации: введение отдельных зерен (OncoSeed) и зерен, фиксированных на жесткой акриловой нити (RAPID Strand).
Преимущества использования RAPID Strand.
- отсутствие риска миграции зерен
- правильное геометрическое расположение зерен - точная дозиметрия
- быстрая зарядка игл - сокращение времени процедуры и воздействия радиации на оператора
- безопасность хранения и транспортировки
Успех процедуры брахитерапии простаты требует тесной работы команды специалистов и зависит как от дозиметрии так и от техники имплантации. Процедура должна выполняться в центрах после специального обучения. Основное преимущество постоянной имплантации заключается в том, что лечение проводится однократно и может выполняться амбулаторно или с последующим однодневным пребыванием в стационаре.
Как показали многочисленные исследования, энергия имплантируемых источников такая низкая, что облучение других людей незначительно и требует чрезвычайно простых методов защиты.
Показания и противопоказания для брахитерапии.
Критерии отбора пациентов:
- Ожидаемая продолжительность жизни более 10 лет
- Гистологически подтвержденная аденокарцинома простаты.
- Заболевание, ограниченное капсулой простаты Т1-Т2С, подтвержденное трансректальным ультразвуковым исследованием и/или эндоректальным ЯМР сканированием.
- Нет доказательств наличия метастазов
- Нет ТУР в анамнезе
- Объем простаты менее 50 куб.см (для железы большего объема гормонотерапия аналогами ЛГРГ+_ блокаторы андрогенов в течение 3 месяцев для уменьшения объема железы менее чем 50 куб.см).
- ПСА < 50нг/мл.
При подтверждении экстракапсулярного распространения рекомендуется наружная лучевая терапия и/или имплантация гибких игл с временным источником. Пациенты, у которых предварительно была выполнена трансуретральная резекция (ТУР), должны быть исключены из группы для постоянной имплантации из-за высокой дозы радиации на уретру и высокого риска развития недержания мочи в этой группе пациентов.
При высоком риске злокачественности рака простаты, например, шкала Глисона более или = 7 или высокий начальный уровень ПСА, некоторые центры комбинируют наружную лучевую терапию с имплантацией радиоактивных зерен.
Процедура брахитерапии.
Процедуру имплантации можно разделить на три части:
1) планирование
2) процедура имплантации
3) оценка после имплантации
ПЛАНИРОВАНИЕ.
Планирование определяет оптимальную дозу распределения радиации на основании изображения, полученного с помощью УЗ или СТ. Изображение простаты от основания до верхушки получают с шагом 0.5 мм, а также идентифицируют прилегающие прямую кишку, уретру, шейку мочевого пузыря.
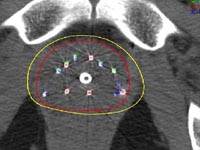
Контуры простаты, прямой кишки и уретры вводятся в компьютер для расчета дозиметрии, т.к. требуют различного расположения игл и источников излучения для получения адекватной дозы радиации в простате, которая в то же время будет безопасна для прямой кишки и уретры. Несмотря на то, что имеются некоторые различия в дозах, общепринятыми минимальными дозами при монотерапии для I-125 являются 140-160 Гр
Шаблон для введения игл ограничивает расстояние между иглами 1 или 0.5 см, а интервал между зернами составляет 1 см. Существуют разные подходы к распределению зерен в разных центрах. Однако общим является расчет дозы, основанной на анатомии каждой индивидуальной предстательной железы, а не на принятом стандарте.
ПРОЦЕДУРА ИМПЛАНТАЦИИ.
|
|
Техника брахитерапии основана на одной или нескольких модификациях закрытого чрезпромежностного доступа, который первоначально был описан Holm и соавторами в 1983 г. Такой подход позволяет проводить имплантацию постоянного источника в амбулаторных условиях. Большинство методик включают УЗ изображение в режиме реального времени или флюороскопию, которые обеспечивают прямую визуализацию положения игл в простате и их координацию на шаблоне.

После спинномозговой или общей анестезии пациент располагается в положении на спине (как для литотомии), УЗ датчик вводится в прямую кишку и фиксируется. Затем устанавливается и фиксируется промежностный шаблон для введения игл. Заправленные источниками иглы вводятся через соответствующие отверстия шаблона согласно предварительному планированию.
Промежностные шаблоны обычно представляют собой жесткую матрицу с определенным расположением отверстий. Шаблон крепится к УЗ датчику, который может быть продвинут вперед или назад для визуализации положения троакаров. Современная ультрасонография позволяет визуализировать как поперечные так и продольные срезы, что позволяет точно разместить иглы. Предстательная железа удивительно подвижный и эластичный орган, и процесс введения игл может привести к ее движению или смещению. В результате окончательное положение зерен может оказаться неточным. Таким образом, мониторинг процесса имплантации позволяет оператору выявить неправильное расположение и переместить зерна.
ОЦЕНКА ПОСЛЕ ИМПЛАНТАЦИИ.
Оценка качества проведенной имплантации обычно проводится методом дозиметрии, основанным на получении КТ изображения. Сканируются как мягкие так и костные ткани для определения объема простаты и положения зерен. Кривая изодозы строится для каждого изображения с детальным анализом распределения радиации относительного рассчитанного на КТ объема железы. На основании полученных данных строятся гистограммы дозы-объема, которые и определяют полученную дозу. На данном этапе не существует четких инструкций относительно влияния данных дозы-объема на исход или степень травматичности процедуры.
Осложнения.
Обычно большинство пациентов после процедуры брахитерапии отмечают уринарные симптомы раздражения. Поздние осложнения незначительные. По опыту Beyer and Piesty и Blasko от 4 до 8% пациентов в послеоперационном периоде нуждаются в минимально инвазивных хирургических процедурах, таких как катетеризация или цистоскопия. Проктит возникает у менее чем 2% пациентов получающих этот вид лечения в качестве основного. Недержание мочи развивается в 0-1% случаев у тех группах, где не выполнялась предварительная ТУР. Там где предварительно была выполнена ТУР, недержание мочи достигало 50%. В литературе имеется сообщение о 19 пациентах с предварительной ТУР, и только у одного развилось недержание мочи при напряжении после имплантации зерен. Такой низкий уровень недержания мочи был достигнут вследствие более отдаленного расположения зерен от уретры. В ранних исследованиях сообщалось о сохранении потенции в 81% случаев и 75% спустя 2-3 года. Blasko и соавт. сообщили, что у 85% моложе 70 лет и 50% старше 70 лет после брахитерапии простаты потенция сохранялась в течение всего периода наблюдения.
Преимущества внутритканевой терапии (имплантация I-125 RAPID Strand) перед хирургическим лечением и наружной лучевой терапией
1.Удобство. Пациентам, получающим монотерапию зернами I-125, процедура может быть выполнена амбулаторно, или пребывание в клинике ограничивается одними сутками. Большинство пациентов могут возвращаться в работе и выполнению обычной работы в течение недели после имплантации.
2. Расходы. Расходы этого вида лечения зависит от системы здравоохранения, принятой в конкретной стране. Данные, полученные из Американской Страховой компании, показали, что имплантация зерен на 25% дешевле, чем наружная лучевая терапия и на 50% дешевле чем радикальная простатэктомия. Эти расчеты включают только прямые расходы и не включают дополнительные непрямые затраты пациентов, которым необходимы ежедневные курсы лучевой терапии, а также расходы, связанные с их длительной нетрудоспособностью.
3. Низкая травматичность Низкий процент недержания мочи, ректальных осложнений, высокая степень сохранения потенции.
4. Приемлемость для пациентов Брахитерапия может быть использована у пациентов, которым не показано радикальное хирургическое лечение, а также у больных, которым противопоказана наружная лучевая терапия вследствие наличия патологии кишечника внутри полей радиации, особенно у пациентов с воспалительными заболеваниями .
5. Эффективность. Результаты брахитерапии эквивалентны таковым при радикальной простатэктомии с точки зрения динамики уровня ПСА. У пациентов леченных наружной лучевой терапией эти показатели хуже по сравнению с брахитерапией простаты.
Могут ли сравниваться результаты различных методов лечения?
К сожалению нет больших рандомизированных исследований, сравнивающих различные виды лечения локализованного рака простаты. Однако в настоящее время проводится много исследований для анализа и оценки факторов, влияющих на исход лечения.
а) Фактор отбора больных
Самое важное значение имеет возраст пациента, общее состояние и наличие сопутствующей патологии. В хирургической группе больные обычно более молодые с незначительной сопутствующей патологией по сравнению с группами пациентов, леченных нехирургическими методами.
б) Характеристика опухолевого процесса.
Пациенты должны отвечать основным прогностическим факторам, которыми являются шкала Глисона, начальный уровень ПСА, стадия опухоли, наличие или отсутствие тазовых л/у.
с) Анализ исхода
При сравнении результатов лечения должны использоваться те же самые параметры, включающие общую выживаемость, рецидивы, метастазирование,
ПСА, осложнения, травматичность и качество жизни.
Заключение
Брахитерапия является по крайней мере таким же эффективным методом терапии как операция или НЛТ. Учитывая степень побочных эффектов, удобство и расходы, брахитерапия должна применяться для лечения больных локализованными формами рака простаты.
