
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология и педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по информатике программированию
Краткое содержание произведений
Реферат: Ароматичні вуглеводні
Реферат: Ароматичні вуглеводні
Опорний конспект
на тему:
"Ароматичні вуглеводні"
Виконав:
учень 10 - А класу
середньої школи № 96
Коркуна Дмитро
1. Ненасичені вуглеводні – це органічні сполуки, що складають ся з Карбону і Гідрогену, в яких атоми Карбону не повністю насичені атомами Гідрогену.
Загальна формула етиленових вуглеводнів – CnH2n
Загальна формула ацетиленових вуглеводнів CnH2n-2
2. Гомологи етилену Гомологи ацетилену:
С2H4 – етилен; C2H2 – ацетилен;
С3H6 – пропен; C3H4 – пропин
C4H8 – бутен; C4H6 – бутин
І т .д І т д
Радикали: СН3 – метил; С2Н5 – етил; С3Н7 пропіл;
Радикал – це атом або група атомів, що містить неспарені електрони
3. Етилен:
С2Н4 Н2С –![]() СН2 Н
: С : : С : Н
СН2 Н
: С : : С : Н
Н Н
молекулярна струтурна електронна формули
Ацетилен:
С2Н2 НС º CH H
: C ![]()
![]() C : H
C : H
H H
Молекулярна структурна електронна формули
Фізичні властивості:
Етилен – безбарвний газ, майже без запаху, малорозчинний у воді, трохи легший за повітря
Ацетилен – безбарвний газ, без запаху, малорозчинний у воді.
Хімічні властивості:
1. як і інші вуглеводні, етилен і ацетилен горять на повітрі з утворенням оксиду карбону (ІV) і води:
СН2 = СН2 +3 О2 ® 2СО2 + Н2О
2СН ºСН+5О3 ®4СО2 +2 Н2О ▲Н = 1307 к Дж.моль
СН4 – W( C) =75%; C2H4 – W( C) =86 %; C2H2 - W( C) = 92%
Чим менша кількість С, тим світліше полум'я
2. Гідрування – приєднання водню
Н2С = СН2 +Н2 ![]() (t0, pt, N) H3C – CH3
(t0, pt, N) H3C – CH3
3. Гідратація – приєдання води
4.
Н2С = СН2
+ Н2О ![]() (t0 , H2SO4) CH3
– CH2 OH
(t0 , H2SO4) CH3
– CH2 OH
4. Якісні реакції
Неповне окиснення Н2С = СН2
+[O] ![]() CH2 – OH
CH2 – OH
|
CH2 – OH
5. Галогенування – приєднання галогеноводню
Н2С = СН2 +Сl2 ® CH2Cl –CH2Cl
6. приєднання галогеноводню, правило Марковніка. При взаємодії ненасичених вуглеводнів з галогеноводнями атом Гідрогену приєднується до більш гідрогенізованого атома Карбону а атом Хлору – до менш гідронізованого
![]()
![]()
![]()
![]()
![]()
![]() Н3С – СН º СН2 +HCl ® HC3
–CHCl –CH3
Н3С – СН º СН2 +HCl ® HC3
–CHCl –CH3
6. Дегідрування
7.
Н2С = СН2
![]() Н º СН + Н2
Н º СН + Н2
4. Характерна ізомерія за місцем розташування подвійного зв'язку:
а) ізомери
СН3 – СН = СН2 – СН3 – 2 бутен
СН2 = СН – СН2 – СН3 – 1 бутен
б) Ізомерія карбонового скелету
СН2 = С – СН3
|
CH3
-1-
Добування ецителену і ацетилену
Етилен та його гомологи утворюють в процесі переробки вуглеводнів, що містяться в нафті. Утворення може відбуватися у результаті термічного розщеплення ненасичених вуглеводнів,.
СН3 –СН2 – СН2 – СН2
– СН3 ![]() СН2 = СН2 + СН3 –СН2
– СН3
СН2 = СН2 + СН3 –СН2
– СН3
Ацетилен, що використовуэться для зварювальних робіт, добувають часто на місці в результаті взаємодії карбіду кальцію з водою: СаС2 + 2Н2О ® НС º СН +Са(ОН)2
Карбід кальцію добувають в результаті нагрівання в електропечах суміші вапна СаО та коксу до температури 2500 0 С: СаО + 3С ®СаС2 +СО
Економічно вигідніше добувати ацетилен з метану нагріванням до температури 15000 С.
2СН4 ® НС º СН + 3Н2
Застосування етилену і ацетилену
З етилену добувають поліетилен, етиловий спирт. Продукт приєднання хлору до етилену –1,2 -дихлорометан є розчинником і засобом знищення шкідників. А продукт приєднання хлороводню – хлороетан є анестезійною речовиною.
Ацетилен використовують для освітлення, для газового різання і зварювання металів. Ацетиленове кисневе полум'я має температуру 2800о С і легко плавить сталь. З ацетилену добувають вихідні речовини для виготовлення пластмас і синтетичних каучуків, він є сировиною для синтезу оцтової кислоти.
-2-
1. Ароматизовані вуглеводні – органічні сполуки, що містять у своєму складі бензольні ядра , у яких можуть бути насичені або ненасичені бічні ланцюги.
Загальна формула – СnH2n-6
1. гомологи бензолу:
бензол – C6H6; тонуол – C7H8 ; ксилол – C8H10; стирол – C9H12.
3. Бензол:
С6Н6 СН2 = СН –С º С–СН = СН2 або СНºС–СН2–СН2–cºCH
Молекулярна структурні формули
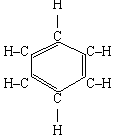
Формула А. Кекуле
У 1845 р. німецький учений А. Кекуле зппропонував формулу, що найкраще відобразила рівноцінність і атомів Карбону, і атомів гідрогену
Після з'ясування електронної будови молекули бензолу, формулу почали записувати так:
2. Фізичні влстивості бензолу:
За звичайних умов бензол – рідина зі специфічним запахом, tкип. 80о С, уводі практично нерозчинний, хоча є розчинником багатьох органічних речовин.
5. Хімічні властивості:
Бензолу характерні реакції заміщення і приєднання:
3. реакція горіння
2С6Н6 +15О2 ®12СО2↑ + 6Н2О
4. Бромування:
Б-Н +Br2
![]() Б-Br
+HBr;
Б-Br
+HBr;
5. Нітрування:
Б-Н + НО–NO2 ®(Н2SO4) Б-NO2 + H2O
4. Реакції приєднання:
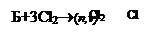 |
|||
а) Хлорування:
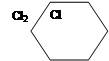 |
б)Б+3Н2
5. Добування
1. меридизація ацетилену:
3НСºСН®([C], 600o) Б
2. Дегідрування циклогексану
С6Н12
![]() 3Н2 + Б
3Н2 + Б
6. Застосування
Бензол є вихідною речовиною речовиною для синтезу величезної кількості неорганічних речовин. Серед них – барвники, лікарські препарати, пахучі речовини, полімери, отрутохімікати, вибухові речовини. Бензол – базова сировина для прмислового органічного синтезу
-1-